DOi:10.13590/j.cjfh.2017.04.011
四川省肉毒梭菌PCR基因分型方法比较研究
(四川省疾病预防控制中心,四川 成都610041)
作者简介: 雷高鹏男副主任技师研究方向为微生物检验及分子生物学E-mail:lionleonleo@126.com
通信作者: 何树森男主任技师研究方向为微生物检验及分子生物学E-mail:heshs@sohu.com
收稿日期: 2017-05-12
基金项目: 食品安全国家标准 食品微生物学检验 肉毒梭菌及肉毒毒素检验(GB 4789.12—XXXX)修订
摘要: 目的比较分析4种肉毒毒素(botulinum neurotoxins,BoNT)基因分型方法,为四川省监测和食物中毒中肉毒梭菌(Clostridium botulinum)分型鉴定提供可靠的方法。方法使用本实验室保存的6株肉毒梭菌(包括A、B、E型)验证4种肉毒梭菌PCR基因分型鉴定方法——美国食品药品监督管理局(FDA)多重PCR分型方法、国际标准化组织(ISO)的两种多重PCR分型方法和一种实时荧光PCR分型方法,比较方法间的差异,并初步分析差异原因。结果3种多重PCR方法均可在一个反应中同时检测A、B、E 3种型别肉毒梭菌。ISO多重PCR方法1中A型检测虽能获得预期条带,但结果条带不清晰。其余两种多重PCR方法在分型检测肉毒梭菌时,可获得清晰的预期条带。实时荧光PCR分型方法能在多重反应体系中同时检测到不同型的肉毒梭菌,但由于荧光标记相同,要获得分型结果需要分别检测各毒素型别。结论美国FDA多重PCR方法和ISO多重PCR方法2操作较简单易行,可在四川省肉毒梭菌监测中推荐使用。
关键词:
肉毒梭菌; 食物中毒; PCR; 基因分型; 食源性致病菌; 比较
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)04-0445-05
Comparative study on PCR genotyping methods of Clostridium botulinum
(Sichuan Province Center for Disease Control and Prevention,Sichuan Chengdu 610041,China)
Abstract:ObjectiveTo compare four PCR genotyping method for Clostridium botulinum, and provide the reliable method for detection and identification of Clostridium botulinum from surveillance and foodborn poisoning in Sichuan Province. MethodsSix strains of C.botulinum types A, B and E were used to compare four PCR genotyping method —one multiplex PCR method was from US FDA, two multiplex PCR method and one real-time PCR method were from ISO, and the differences were preliminarily analyzed. ResultsThree multiplex PCR method could detect C.botulinum types A, B and E in a single reaction. The expected bands for type A were vague using ISO multiplex PCR method 1, whereas bright expected bands could be obtained in the identification of C.botulinum by the other two multiplex PCR method . Real-time multiplex PCR method could detect different types of C.botulinum simultaneously; however, classification should be carried out separately because fluorescent labels were the same. ConclusionMultiplex PCR method from FDA and multiplex PCR method 2 from ISO were relatively simple and could be recommended for C.botulinum surveillance in Sichuan Province.
Key words:
Clostridium botulinum; foodborne poisoning; polymerase chain reaction; genotyping; foodborne pathogenic bacteria; comparative
肉毒梭菌(Clostridium botulinum,以下简写为C.botulinum)是一类能够产生肉毒毒素(botulinum neurotoxins,BoNTs)的革兰阳性厌氧梭菌。肉毒毒素是最强的神经麻痹毒素之一,误食会导致肌肉迟缓型麻痹即肉毒中毒,致死率高。至今已证实肉毒毒素有7种血清型(A~G),其中A、B、E和F为引起人肉毒中毒的主要型别,C和D引起动物肉毒中毒,目前还没有充分证据表明G型能够引起中毒暴发[1]。根据肉毒毒素蛋白序列分析将同一血清型肉毒毒素中序列差异超过2.6%的分为不同亚型,已报道肉毒毒素A型和B型各有8个亚型(BoNT/A1~A8,BoNT/B1~B8),E型有12个亚型(BoNT/E1~E12),F型有7个亚型(BoNT/F1~F7)[2]。
肉毒梭菌分型鉴定的标准方法是通过发酵产毒后再用小鼠毒素中和试验检测。但该方法检测时间长、对实验室和耗材都有较高的要求,难以在肉毒梭菌的检验与监测中广泛使用。2013年的梭菌奶粉污染事件中,由于检测机构未能采用适当的鉴定方法而误把生孢梭菌鉴定为肉毒梭菌,造成了巨大的经济损失和社会影响,让人们重新关注食品中肉毒梭菌的鉴定。随着分子生物学技术的发展,美国食品药品监督管理局(FDA)[3]及国际标准化组织(ISO)[4]在肉毒梭菌检测中引入了酶联免疫吸附测定(ELISA)、PCR分型检测的方法。基于肉毒毒素基因的PCR分型方法降低了实验室要求和试验成本、提高了检测速度,使得肉毒梭菌的分型鉴定更加简单易行。
近年来我国每年都有肉毒中毒事件发生,主要发生在新疆、青海,西藏地区[5-6]。A型和B型肉毒中毒在我国各地均有发生,而E型主要发生在青藏高原地区,在我国未见F型肉毒中毒的报道。四川省西部位于青藏高原边缘,生食自制发酵和风干食品发生过多次肉毒梭菌食物中毒。四川省自1990年甘孜州报告第一起肉毒梭菌食物中毒以来[7],已经确诊6起肉毒梭菌食物中毒,其中2016年就报告了2起肉毒梭菌食物中毒事件,这6起事件中所分离的肉毒梭菌血清型包括A、B和E 3种血清型。对分离得到的肉毒梭菌进行鉴定时,本实验室曾采用一对简并引物检测4种不同型别肉毒梭菌的方法[7]。虽然该方法能鉴定肉毒梭菌,但不具备分型的能力。肉毒梭菌PCR分型鉴定方法的运用能有效提升食品风险监测和食物中毒调查中肉毒梭菌实验室检测的准确性。
肉毒毒素基因多样性高,现已有的PCR分型鉴定方法均依据国外报道的肉毒毒素基因序列设计。本试验通过比较国外4种肉毒梭菌PCR基因分型方法(美国FDA多重PCR分型方法、ISO的两种多重PCR分型方法和一种实时荧光PCR分型方法)对本实验室保存的6株肉毒梭菌进行分型检测的有效性分析,并筛选出适合四川省的肉毒梭菌分型鉴定方法,为四川省肉毒梭菌监测提供可靠的检验方法。
GQ180065(CDC42961)、BoNT/A2:NC_012563(Kyoto)、BoNT/A3:GQ241940(CDC40234)、BoNT/A4:DQ185901(657Ba)、BoNT/A5:HM153705(A661222)、BoNT/A6:FJ981696(CDC41370)、BoNT/A7:JQ954969(2008-148)、BoNT/A8:KF667385(217-12)。
胰蛋白胨葡萄糖酵母浸膏肉汤(TPGY)培养基(青岛海博生物),MiniBEST Bacteria Genomic DNA Extraction Kit试剂盒、Mighty TA-cloning Kit试剂盒均购自日本TaKaRa,2× Go Taq Green Master Mix(美国Promega),2× Taqman Universal PCR MasterMix(美国Life Technology)。引物和Taqman探针由成都擎科梓熙生物技术有限公司合成[3-4]。
单重实时荧光PCR和多重实时荧光PCR检测均得到相应阳性结果,见图2。与单重检测比较,多重检测仅偏大1~2个PCR循环数(Ct)值。
含有ISO-A1F/R区域的A型肉毒毒素基因片段与已知A1~A8亚型的序列比对结果见图3。
对ISO-A1F/R引物设计区域分析可以发现,ISO-A1F区碱基保守度不高,21个碱基中有9个位置存在可变碱基。ISO-A1F引物序列在近3′端除使用简并碱基的第三位外,在第二位上与BoNT/A7有T-C不匹配,在第六位上与本试验的XCA和BoNT/A5有A-G不匹配,与BoNT/A6在第六到第八位上出现了连续不匹配的情况。ISO-A1R区域中碱基保守度较高,但在近3′端的第五位上与BoNT/A7仍有A-G不匹配。
小鼠毒素中和试验能灵敏的检测肉毒毒素并分型,但在肉毒梭菌监测中需要更加快速、高通量、准确的方法来对检出的梭菌进行分型鉴定。肉毒毒素为肉毒毒素基因编码的蛋白质,所有产肉毒毒素的菌株都携带有肉毒毒素基因,菌株中肉毒毒素基因的型别直接决定了菌株毒素的型别,因此肉毒毒素基因分型与毒素分型有高度的一致性。肉毒梭菌PCR分型检测避免了动物试验,无需采购昂贵且难以获得的各种抗血清。在检测周期上与动物试验比较,PCR检测只需要2 d的增菌培养和4~6 h的检测时间。在肉毒梭菌的分离平板上,肉毒梭菌与其他梭菌形态相近难以区分,导致需鉴定菌株数量较大,而PCR检测由于高通量在大量样品的检测中优势更加明显。肉毒梭菌PCR分型鉴定方法更加适合食品质量控制和环境监测中的肉毒梭菌检测。该方法已经被美国FDA和ISO用于肉毒中毒的调查和监测工作。
肉毒毒素型别多样,与人相关的4种肉毒血清型多达35个亚型,不同血清型间氨基酸差异能达到60%以上[2]。同一血清型中,A型和F型的型别内的差异性较大,A1~A6内氨基酸水平差异为16%,F1~F7内差异为36%,而B型和E型的型别内差异较小,各自为7%和6%[1]。不同肉毒毒素基因核酸水平相似性低,设计通用引物检测肉毒毒素基因难度大,而简并碱基的使用易造成扩增效率降低或误扩增[5]。多重PCR避免了检测时不同血清型间差异较大难以兼顾的问题,在完成检出的同时也进行分型。美国FDA和ISO提供的PCR方法中均采用了多重反应的方案。但美国FDA方法在检测携带多个毒素基因的肉毒梭菌时,可能不能同时检出全部的毒素基因,因此推荐采用单重检测的方法[8]。由于荧光标记种类和引物设计的限制,实时荧光PCR的多重检测难度较高。ISO发布的实时荧光多重PCR检测肉毒梭菌的方法,在一个反应中能同时检测不同型别肉毒梭菌,与ISO实时荧光单重PCR检测比较Ct值也相近,表明该实时荧光多重PCR检测效果稳定。但该方法各型的探针荧光标记均为FAM,多重反应时不能区分型别,如要分型则需各型分开单独反应[11],增加了PCR反应次数和检测时间。随着PCR反应技术和电泳技术的改进,普通PCR检测时间缩短,因而普通多重PCR方法更适合于肉毒梭菌的检测和分型。
肉毒梭菌多重PCR检测的3种方法中,ISO方法相比FDA方法优化了扩增片段大小,使得扩增片段差异更大,方便结果的判读。ISO方法1中虽然扩增片段大小按A、B、E、F依次递增,方便读取[9-10],但A型扩增的所得条带不清晰。与其他引物比较,ISO-A1F/R在两个位置上使用了简并碱基,并且ISO-A1R近3′端六个碱基中使用了5个T和1个A。ISO-A1F/R在3′端不稳定的设计降低了引物结合效率,不利于PCR扩增。ISO-A1F引物序列与XCA除在简并碱基位置外,在近3′端第六位上也出现了G-A不匹配(图3),使其扩增效率进一步降低(图1a)。试验表明ISO方法1不适合四川省肉毒梭菌的分型检测。在我国的肉毒梭菌检验中,少有分离肉毒梭菌和检测肉毒毒素基因,缺乏肉毒毒素基因序列相关数据,亚型种类状况不清楚。由于肉毒毒素型别多样,国外报道的肉毒梭菌分型检测方法在应用时存在不确定性。通过本试验比较,FDA及ISO方法2均能有效的检测四川省A、B和E型肉毒毒素基因,可用于四川省肉毒梭菌的监测。
在我国,虽然肉毒中毒事件时有发生,但对环境和食品中肉毒梭菌污染状况未有全面的调查和分析报告。肉毒梭菌食物中毒受到地域和饮食习惯的影响,中毒食品多为生食发酵食品。为有效预防肉毒中毒事件的发生,肉毒中毒高发地区需要开展高危食品的风险评估。PCR分型方法有利于肉毒中毒高发地区自主开展食品和环境中肉毒梭菌监测工作,获得当地肉毒梭菌污染状况及毒素型别,对预防当地肉毒中毒事件的发生和中毒人员的治疗具有指导意义。
肉毒梭菌分型鉴定的标准方法是通过发酵产毒后再用小鼠毒素中和试验检测。但该方法检测时间长、对实验室和耗材都有较高的要求,难以在肉毒梭菌的检验与监测中广泛使用。2013年的梭菌奶粉污染事件中,由于检测机构未能采用适当的鉴定方法而误把生孢梭菌鉴定为肉毒梭菌,造成了巨大的经济损失和社会影响,让人们重新关注食品中肉毒梭菌的鉴定。随着分子生物学技术的发展,美国食品药品监督管理局(FDA)[3]及国际标准化组织(ISO)[4]在肉毒梭菌检测中引入了酶联免疫吸附测定(ELISA)、PCR分型检测的方法。基于肉毒毒素基因的PCR分型方法降低了实验室要求和试验成本、提高了检测速度,使得肉毒梭菌的分型鉴定更加简单易行。
近年来我国每年都有肉毒中毒事件发生,主要发生在新疆、青海,西藏地区[5-6]。A型和B型肉毒中毒在我国各地均有发生,而E型主要发生在青藏高原地区,在我国未见F型肉毒中毒的报道。四川省西部位于青藏高原边缘,生食自制发酵和风干食品发生过多次肉毒梭菌食物中毒。四川省自1990年甘孜州报告第一起肉毒梭菌食物中毒以来[7],已经确诊6起肉毒梭菌食物中毒,其中2016年就报告了2起肉毒梭菌食物中毒事件,这6起事件中所分离的肉毒梭菌血清型包括A、B和E 3种血清型。对分离得到的肉毒梭菌进行鉴定时,本实验室曾采用一对简并引物检测4种不同型别肉毒梭菌的方法[7]。虽然该方法能鉴定肉毒梭菌,但不具备分型的能力。肉毒梭菌PCR分型鉴定方法的运用能有效提升食品风险监测和食物中毒调查中肉毒梭菌实验室检测的准确性。
肉毒毒素基因多样性高,现已有的PCR分型鉴定方法均依据国外报道的肉毒毒素基因序列设计。本试验通过比较国外4种肉毒梭菌PCR基因分型方法(美国FDA多重PCR分型方法、ISO的两种多重PCR分型方法和一种实时荧光PCR分型方法)对本实验室保存的6株肉毒梭菌进行分型检测的有效性分析,并筛选出适合四川省的肉毒梭菌分型鉴定方法,为四川省肉毒梭菌监测提供可靠的检验方法。
1材料与方法
1.1材料
1.1.1菌株来源
试验中所用6株肉毒梭菌,5株分离自肉毒中毒事件,1株由中科院食监所提供(64005),其中A、B和E型肉毒梭菌各2株,见表1。各肉毒梭菌血清型均通过小鼠毒素中和试验确认。
1.1.2A型肉毒毒素基因不同亚型序列
试验中所用A1~A8各亚型基因序列由美国国家生物技术信息中心(NCBI)上获得,本试验所用各亚型肉毒梭菌序列NCBI编号如下:BoNT/A1:
|
表1试验所用肉毒梭菌菌株 Table 1C.botulinum strains used in this study 注:—表示无相关信息 |
1.1.3主要仪器与试剂
Vriti 96 PCR仪、7500实时荧光PCR仪均购自美国Life Technology,QIACEL毛细管电泳仪(德国Qiagen)。胰蛋白胨葡萄糖酵母浸膏肉汤(TPGY)培养基(青岛海博生物),MiniBEST Bacteria Genomic DNA Extraction Kit试剂盒、Mighty TA-cloning Kit试剂盒均购自日本TaKaRa,2× Go Taq Green Master Mix(美国Promega),2× Taqman Universal PCR MasterMix(美国Life Technology)。引物和Taqman探针由成都擎科梓熙生物技术有限公司合成[3-4]。
1.2方法
1.2.1肉毒梭菌基因组提取
将肉毒梭菌接种于TPGY培养基,30 ℃厌氧培养24~48 h,用MiniBEST Bacteria Genomic DNA Extraction Kit提取全基因组DNA,并测定DNA浓度,稀释至10 ng/μl。
1.2.2肉毒梭菌多重PCR检测
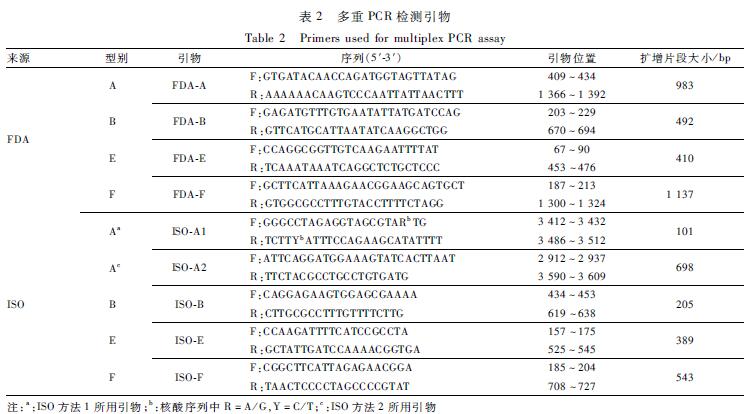
肉毒梭菌多重PCR检测参考美国FDA[3,8]及ISO[4,9-10]方法进行。试验中多重PCR使用Vriti 96 PCR仪。多重PCR反应体系中同时加入4对引物,分别检测A、B、E、F 4型肉毒毒素基因,所用引物见表2。ISO提供了两种多重PCR方法,其区别在A型肉毒梭菌检测引物有变化,而其他3型所用引物相同。混合检测时等量混合6株肉毒梭菌基因组DNA作为DNA模版。反应体系(50 μl):2× GoTaq Green Master Mix 25 μl、引物各0.3 μmol/L、DNA模版50 ng、去离子水补足50 μl。反应条件为:95 ℃预变性15 min;95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸90 s循环35次;最后72 ℃延伸10 min。PCR结果通过毛细管电泳仪检测。
|
表2多重PCR检测引物 Table 2Primers used for multiplex PCR assay 注:a:ISO方法1所用引物;b:核酸序列中R=A/G,Y=C/T;c:ISO方法2所用引物 |
1.2.3肉毒梭菌实时荧光PCR检测
肉毒梭菌实时荧光PCR检测参考ISO[4,11]方法进行,方法中4种毒素基因探针均选用6-羧基荧光素(FAM)荧光标记,引物见表3。单重实时荧光PCR反应时一个反应体系里只加入一套引物和探针,多重实时荧光PCR反应时同时将四套引物和探针加至同一反应体系中进行PCR。反应体系(25 μl):2× Taqman Universal PCR MasterMix 12.5 μl、引物各0.3 μmol/L、相应Taqman探针各0.2 μmol/L、DNA模版50 ng,加水至25 μl。反应条件为95 ℃预变性10 min;95 ℃变性15 s、60 ℃恒温60 s,循环35次。

|
表3ISO中实时荧光PCR引物 Table 3Primers used for real-time PCR assay from ISO 注:a:核酸序列中K=T/G |
1.2.4A型肉毒基因不同亚型引物区域序列比对
以ISO-A2F/R扩增LZA和XCA的A型肉毒毒素基因获得包含ISO-A1F/R区域的PCR片段,进行T-A克隆测序,将所获序列与A1~A8基因序列采用MEGA 6.0软件进行序列比对。
2结果
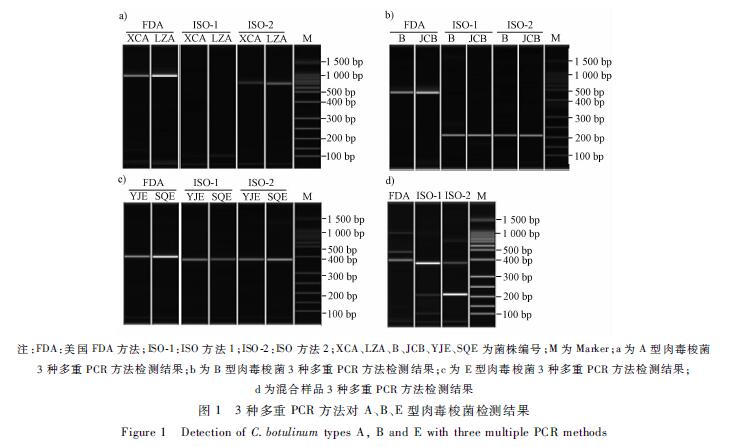
多重PCR结果见图1,FDA、ISO方法1、ISO方法2均能检出相应的肉毒毒素基因。除ISO方法1中检测A型时所获条带较不清晰外(见图1a中第三、第四泳道),其他检测方法条带清晰。多重混合检测时,ISO的两个方法三个条带相距较远易辨认,FDA方法中B和E型的产物大小仅相差82 bp,在无适合对照的情况下难以准确判断。单重实时荧光PCR和多重实时荧光PCR检测均得到相应阳性结果,见图2。与单重检测比较,多重检测仅偏大1~2个PCR循环数(Ct)值。
含有ISO-A1F/R区域的A型肉毒毒素基因片段与已知A1~A8亚型的序列比对结果见图3。
对ISO-A1F/R引物设计区域分析可以发现,ISO-A1F区碱基保守度不高,21个碱基中有9个位置存在可变碱基。ISO-A1F引物序列在近3′端除使用简并碱基的第三位外,在第二位上与BoNT/A7有T-C不匹配,在第六位上与本试验的XCA和BoNT/A5有A-G不匹配,与BoNT/A6在第六到第八位上出现了连续不匹配的情况。ISO-A1R区域中碱基保守度较高,但在近3′端的第五位上与BoNT/A7仍有A-G不匹配。
3讨论
肉毒梭菌和其他种类的梭菌如:生孢梭菌、巴氏梭菌、丁酸梭菌十分相似,通过经典的细菌学方法难以鉴定分型[12]。
|
注:FDA:美国FDA方法;ISO-1:ISO方法1;ISO-2:ISO方法2;XCA、LZA、B、JCB、YJE、SQE为菌株编号;M为Marker;a为A型肉毒梭菌 3种多重PCR方法检测结果;b为B型肉毒梭菌3种多重PCR方法检测结果;c为E型肉毒梭菌3种多重PCR方法检测结果; d为混合样品3种多重PCR方法检测结果 图13种多重PCR方法对A、B、E型肉毒梭菌检测结果 Figure 1Detection of C.botulinum types A, B and E with three multiple PCR methods |
|
注:实线为单重实时荧光PCR结果,虚线为多重实时 荧光PCR结果;菌株编 号:XCA、LZA、B、JCB、YJE、SQE 图2实时荧光PCR对A、B、E型肉毒梭菌检测结果 Figure 2Detection of C.botulinum types A, B and E with real-time PCR method |

|
注:LZA和XCA为菌株编号;primer为引物序列;粗体 标识为引物序列中简并碱基;灰色底色为保守碱基, 黑色底色为相似度碱基 图3ISO方法1中A型引物区域序列比对 Figure 3Sequence alignment of type A primer region from ISO method 1 |
肉毒毒素型别多样,与人相关的4种肉毒血清型多达35个亚型,不同血清型间氨基酸差异能达到60%以上[2]。同一血清型中,A型和F型的型别内的差异性较大,A1~A6内氨基酸水平差异为16%,F1~F7内差异为36%,而B型和E型的型别内差异较小,各自为7%和6%[1]。不同肉毒毒素基因核酸水平相似性低,设计通用引物检测肉毒毒素基因难度大,而简并碱基的使用易造成扩增效率降低或误扩增[5]。多重PCR避免了检测时不同血清型间差异较大难以兼顾的问题,在完成检出的同时也进行分型。美国FDA和ISO提供的PCR方法中均采用了多重反应的方案。但美国FDA方法在检测携带多个毒素基因的肉毒梭菌时,可能不能同时检出全部的毒素基因,因此推荐采用单重检测的方法[8]。由于荧光标记种类和引物设计的限制,实时荧光PCR的多重检测难度较高。ISO发布的实时荧光多重PCR检测肉毒梭菌的方法,在一个反应中能同时检测不同型别肉毒梭菌,与ISO实时荧光单重PCR检测比较Ct值也相近,表明该实时荧光多重PCR检测效果稳定。但该方法各型的探针荧光标记均为FAM,多重反应时不能区分型别,如要分型则需各型分开单独反应[11],增加了PCR反应次数和检测时间。随着PCR反应技术和电泳技术的改进,普通PCR检测时间缩短,因而普通多重PCR方法更适合于肉毒梭菌的检测和分型。
肉毒梭菌多重PCR检测的3种方法中,ISO方法相比FDA方法优化了扩增片段大小,使得扩增片段差异更大,方便结果的判读。ISO方法1中虽然扩增片段大小按A、B、E、F依次递增,方便读取[9-10],但A型扩增的所得条带不清晰。与其他引物比较,ISO-A1F/R在两个位置上使用了简并碱基,并且ISO-A1R近3′端六个碱基中使用了5个T和1个A。ISO-A1F/R在3′端不稳定的设计降低了引物结合效率,不利于PCR扩增。ISO-A1F引物序列与XCA除在简并碱基位置外,在近3′端第六位上也出现了G-A不匹配(图3),使其扩增效率进一步降低(图1a)。试验表明ISO方法1不适合四川省肉毒梭菌的分型检测。在我国的肉毒梭菌检验中,少有分离肉毒梭菌和检测肉毒毒素基因,缺乏肉毒毒素基因序列相关数据,亚型种类状况不清楚。由于肉毒毒素型别多样,国外报道的肉毒梭菌分型检测方法在应用时存在不确定性。通过本试验比较,FDA及ISO方法2均能有效的检测四川省A、B和E型肉毒毒素基因,可用于四川省肉毒梭菌的监测。
在我国,虽然肉毒中毒事件时有发生,但对环境和食品中肉毒梭菌污染状况未有全面的调查和分析报告。肉毒梭菌食物中毒受到地域和饮食习惯的影响,中毒食品多为生食发酵食品。为有效预防肉毒中毒事件的发生,肉毒中毒高发地区需要开展高危食品的风险评估。PCR分型方法有利于肉毒中毒高发地区自主开展食品和环境中肉毒梭菌监测工作,获得当地肉毒梭菌污染状况及毒素型别,对预防当地肉毒中毒事件的发生和中毒人员的治疗具有指导意义。
参考文献
[1]DORNER M B, SCHULZ K M, KULL S, et al. Complexity of botulinum neurotoxins: challenges for detection technology[J]. Curr Top Microbiol Immunol, 2013, 364:219-255.
[2]KULL S, SCHULZ K M, WEISEMANN J, et al. Isolation and functional characterization of the novel Clostridium botulinum neurotoxin A8 subtype[J]. PLoS One, 2015, 10(2):e0116381.
[3]SOLOMON H M, LILLY T. Bacteriological analytical manual (BAM) chapter 17: Clostridium botulinum[M]. FDA, 2001.
[4]International Organization for Standardization. ISO/TS 17919-2013 Microbiology of the food chain-polymerase chain reaction (PCR) for the detection of food-borne pathogens-detection of botulinum type A, B, E and F neurotoxin-producing Clostridia[S]. 2013.
[5]葛华,席陪华,来身德,等. 青海省13起肉毒毒素中毒检测结果分析[J]. 中华预防医学杂志, 2008, 42(4):287.
[6]蔺春玲,郭莉莎,杨玲,等. 新疆伊犁地区察布查尔病10年分布现状调查分析[J]. 第二军医大学学报, 2011, 32(5):572-574.
[7]赵晋,郭宗琪,杨小蓉,等. 聚合酶链式反应对食物中肉毒的检测[J]. 预防医学情报杂志, 2006, 22(1): 113-115.
[8]CRAVEN K E, FERREIRA J L, HARRISON M A, et al. Specific detection of Clostridium botulinum types A, B, E, and F using the polymerase chain reaction[J]. J AOAC Int, 2002, 85(5):1025-1028.
[9]DE MEDICI D, ANNIBALLI F, WYATT G M, et al. Multiplex PCR for detection of botulinum neurotoxin-producing Clostridia in clinical, food, and environmental samples[J]. Appl Environ Microbiol, 2009, 75(20):6457-6461.
[10]LINDSTRM M, KETO R, MARKKULA A, et al. Multiplex PCR assay for detection and identification of Clostridium botulinum types A, B, E, and F in food and fecal material[J]. Appl Environ Microbiol, 2001, 67(12):5694-5699.
[11]FACH P, MICHEAU P, MAZUET C, et al. Development of real-time PCR tests for detecting botulinum neurotoxins A, B, E, F producing Clostridium botulinum, Clostridium baratii and Clostridium butyricum[J]. J Appl Microbiol, 2009, 107(2):465-473.
[12]COLLINS M D, EAST A K. Phylogeny and taxonomy of the food-borne pathogen Clostridium botulinum and its neurotoxins[J]. J Appl Microbiol, 1998, 84(1):5-17.
[2]KULL S, SCHULZ K M, WEISEMANN J, et al. Isolation and functional characterization of the novel Clostridium botulinum neurotoxin A8 subtype[J]. PLoS One, 2015, 10(2):e0116381.
[3]SOLOMON H M, LILLY T. Bacteriological analytical manual (BAM) chapter 17: Clostridium botulinum[M]. FDA, 2001.
[4]International Organization for Standardization. ISO/TS 17919-2013 Microbiology of the food chain-polymerase chain reaction (PCR) for the detection of food-borne pathogens-detection of botulinum type A, B, E and F neurotoxin-producing Clostridia[S]. 2013.
[5]葛华,席陪华,来身德,等. 青海省13起肉毒毒素中毒检测结果分析[J]. 中华预防医学杂志, 2008, 42(4):287.
[6]蔺春玲,郭莉莎,杨玲,等. 新疆伊犁地区察布查尔病10年分布现状调查分析[J]. 第二军医大学学报, 2011, 32(5):572-574.
[7]赵晋,郭宗琪,杨小蓉,等. 聚合酶链式反应对食物中肉毒的检测[J]. 预防医学情报杂志, 2006, 22(1): 113-115.
[8]CRAVEN K E, FERREIRA J L, HARRISON M A, et al. Specific detection of Clostridium botulinum types A, B, E, and F using the polymerase chain reaction[J]. J AOAC Int, 2002, 85(5):1025-1028.
[9]DE MEDICI D, ANNIBALLI F, WYATT G M, et al. Multiplex PCR for detection of botulinum neurotoxin-producing Clostridia in clinical, food, and environmental samples[J]. Appl Environ Microbiol, 2009, 75(20):6457-6461.
[10]LINDSTRM M, KETO R, MARKKULA A, et al. Multiplex PCR assay for detection and identification of Clostridium botulinum types A, B, E, and F in food and fecal material[J]. Appl Environ Microbiol, 2001, 67(12):5694-5699.
[11]FACH P, MICHEAU P, MAZUET C, et al. Development of real-time PCR tests for detecting botulinum neurotoxins A, B, E, F producing Clostridium botulinum, Clostridium baratii and Clostridium butyricum[J]. J Appl Microbiol, 2009, 107(2):465-473.
[12]COLLINS M D, EAST A K. Phylogeny and taxonomy of the food-borne pathogen Clostridium botulinum and its neurotoxins[J]. J Appl Microbiol, 1998, 84(1):5-17.
 雷高鹏,杨小蓉,黄玉兰,何树森.四川省肉毒梭菌PCR基因分型方法比较研究[J].中国食品卫生杂志,2017,29(4):445-449.
雷高鹏,杨小蓉,黄玉兰,何树森.四川省肉毒梭菌PCR基因分型方法比较研究[J].中国食品卫生杂志,2017,29(4):445-449.