DOi:10.13590/j.cjfh.2017.01.004
即食食品中单核细胞增生李斯特菌的血清学分型和毒力基因分析
(1.中国疾病预防控制中心营养与健康所,北京100050; 2.雀巢(中国)有限公司, 北京100016; 3.国家食品安全风险评估中心,北京100022)
通信作者: 郭云昌男研究员研究方向为食品微生物
收稿日期: 2016-11-05
基金项目: 卫生行业科研专项(201302005)
摘要:目的 掌握即食食品中单核细胞增生李斯特菌(简称单增李斯特菌)的血清型、谱系和感染相关基因的分布。方法以全国食源性致病菌监测网中2007—2009年自即食食品分离的226株单增李斯特菌为研究对象,采用传统的血清学分型技术和等位基因特异性寡核苷酸PCR方法(ASO-PCR)研究其血清学分型,并采用PCR方法检测其与感染相关的基因。结果226株单增李斯特菌血清学分型结果显示,1/2a、1/2b、1/2c、4b为主要血清型,比例分别为41.59%(94/226)、40.71%(92/226)、10.62%(24/226)和5.31%(12/226)。引起人类疾病的常见血清型1/2a、1/2b和4b菌株占87.61%(198/226)。谱系Ⅰ菌株为105株,谱系Ⅱ菌株为120株,谱系Ⅲ菌株为1株;我国绝大部分即食食品中单增李斯特菌分离株的感染相关基因缺失率较低,只有个别菌株缺失感染相关基因。结论本研究通过对分离自即食食品中的单增李斯特菌进行血清学分型、谱系分析和感染相关基因的检测,提示我国需要加强食品场所卫生管理,降低单增李斯特菌对即食食品的感染风险。
关键词:
单核细胞增生李斯特菌; 即食食品; 血清学分型; 毒力基因; 基因检测; 食源性致病菌
文章编号:1004-8456(2017)01-0014-05 中图分类号: R155 文献标识码:A
Serological typing and virulence-associated genes analysis of Listeria monocytogenes isolated from ready-to-eat foods
(1.National Institute for Nutrition and Health, Chinese Center for Disease Control and Prevention,Beijing 100050,China;2.Nestle(China)Company Limited, Beijing 100016, China; 3.China National Center for Food Safety Risk Assessment, Beijing 100022, China)
Abstract:Objective To investigate the serotype, genealogy and infection-related genes of Listeria monocytogenes isolated from ready-to-eat foods.MethodsTwo hurdred and twenty-six Listeria monocytogenes isolated from ready-to-eat foods from 2007 to 2009 were collected from the National Foodborne Pathogen Surveillance Network. The serological typing was carried out using conventional serological typing and allele-specific oligonucleotide PCR (ASO-PCR). And their infection-related genes were detected by PCR. ResultsAmong the 226 Listeria monocytogenes isolates from ready-to-eat foods, serovar 1/2a (41.59%,94/226) and 1/2b (40.71%,92/226) were dominant followed by serovar 1/2c (10.62%,24/226) and 4b (5.31%,12/226). The rate of human infection related serovar 1/2a, 1/2b and 4b was relatively high (87.61%,198/226), which indicated the potential risk in ready-to-eat foods. There were 105 strains of lieage I and 120 of lieage II, only one strain of lieage III. Virulence-associated genes were rarely missing in Listeria monocytogenes strains isolated from ready-to-eat foods indicating a high risk.ConclusionAccording to the serology and virulence genes distribution of Listeria monocytogenes isolated from ready-to-eat foods, food sanitation management should be strengthened to reduce the risk of infecti
Key words:
Listeria monocytogenes; ready-to-eat food; serotype typing; virulence gene; gene detection; foodborne pathogens
单核细胞增生李斯特菌(Listeria monocytogenes),简称单增李斯特菌,革兰阳性无芽胞兼性厌氧短杆菌,广泛分布于自然界中,在肉类、蛋类、禽类、海产品、乳制品和蔬菜中均有存在。它是一种重要的食源性致病菌,能引起人、畜的李斯特菌病,易感人群主要为孕妇、新生儿、老年人和免疫缺陷人群[1],感染后主要表现为败血症、脑膜炎和单核细胞增多。世界卫生组织(WHO)将其列为仅次于大肠埃希菌O157、沙门菌、志贺菌后的第四大重要的食源性致病菌。 2011年,美国因甜瓜受单增李斯特菌污染,导致波及全国的疾病暴发,147人生病,33人死亡[2]。2014年丹麦国家血清学院报道,由于一家食品公司生产的冷切肉受李斯特菌的污染造成24人感染李斯特菌[3]。我国各地食品监测结果显示单增李斯特菌污染在肉及肉制品中普遍存在[4]。2008年,有研究首次对2003—2006年由北京口岸挪威进口三文鱼的单增李斯特菌进行血清学分型,所分离的菌株中97%是引起李斯特菌病的菌株[5]。近年来国内外报道的李斯特菌对食品的污染,特别是对即食食品所造成的污染有上升的趋势[6]。低温冷藏的即食食品特别是动物性食品被认为是单增李斯特菌主要的传染源。2016年1月北京市1名孕21周的孕妇因发热、心悸、胎动减少住院,诊断为李斯特菌病,经检测该研究中此例孕妇感染李斯特菌的可疑食品为牛肉三明治,是北京某公司生产的散装冷藏食品,与国内外报道的常见污染食品一致[7]。我国有些地方和餐饮场所卫生条件不达标,致病菌繁殖几率较大,即食食品中单增李斯特菌感染的风险较高。
全国食源性致病菌监测网的菌株涵盖范围广,有良好的代表性,能够基本代表我国即食食品中单增李斯特菌血清型和谱系的分布。本研究对分离自2007—2009年的1 065株单增李斯特菌中的226株即食食品株进行血清学分型、谱系分析和感染相关基因检测。
单增李斯特菌血清(日本生研),Taq酶、dNTPs、10×buffer均购自大连宝生物工程有限公司,96孔PCR反应板,溴化乙锭,琼脂糖,PCR扩增引物(上海生工有限公司),DNA提取试剂盒(天根)。
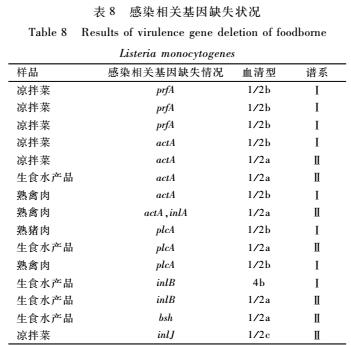
缺失5株;inlB检出率为99.12%(224/226),缺失2株;inlA、inlJ、bsh检出率均为99.56%(225/226),各缺失1株。感染相关基因缺失状况详见表8。
全国食源性致病菌监测网的菌株涵盖范围广,有良好的代表性,能够基本代表我国即食食品中单增李斯特菌血清型和谱系的分布。本研究对分离自2007—2009年的1 065株单增李斯特菌中的226株即食食品株进行血清学分型、谱系分析和感染相关基因检测。
1材料与方法
1.1材料
1.1.1菌株
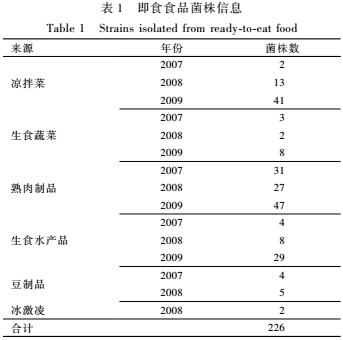
分离自全国食源性致病菌监测网2007—2009年中的即食食品株226株。具体信息见表1。
1.1.2主要仪器与试剂
DNA Engine Tetradrachm2 PCR仪、Sub-Cell Model 96 Cell电泳仪、GEL DOC XR凝胶成像系统均购自美国Bio-Rad,PowerPactMBasic电泳槽、纯水仪、移液器、漩涡振荡器。单增李斯特菌血清(日本生研),Taq酶、dNTPs、10×buffer均购自大连宝生物工程有限公司,96孔PCR反应板,溴化乙锭,琼脂糖,PCR扩增引物(上海生工有限公司),DNA提取试剂盒(天根)。
1.2方法
1.2.1血清学分型
单增李斯特菌的血清型由O抗原和H抗原共同决定。将-80 ℃保存的单增李斯特菌活化,按照单增李斯特血清使用说明书进行, O抗原采用薄片凝集法,H抗原采用试管凝集法,将活化的菌株分别
|
表1即食食品菌株信息
Table 1Strains isolated from ready-to-eat food
|
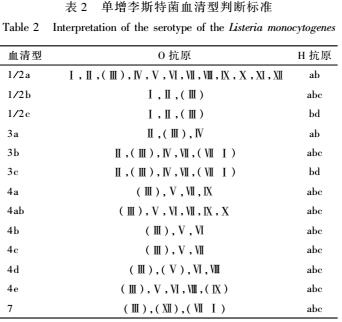
进行血清学分型。血清型判定标准见表2。
|
表2单增李斯特菌血清型判断标准
Table 2 Interpretation of the serotype of the Listeria monocytogenes
|
1.2.2谱系分析
谱系分析使用Ward等[8]基于李斯特Ⅰ型毒力岛(LIP-1)的等位基因特异性寡核苷酸PCR(ASO-PCR)方法用于确定单增李斯特菌的谱系。将-80 ℃保存的目标菌接种于脑心浸液肉汤(BHI)中37 ℃过夜培养;然后划线接种脑心浸液琼脂(BHA)平板纯培养,挑取BHA上的单菌落再接种于BHI中培养;最后按照试剂盒说明提取DNA模板后再进行PCR扩增反应。多重PCR反应条件为94 ℃预变性240 s;94 ℃变性15 s;56 ℃退火10 s;72 ℃延伸10 s,72 ℃终延伸240 s,25个循环。引物序列见表3。
1.2.3感染相关基因检测
所有菌株使用PCR方法用于感染相关基因的检测。将-80 ℃中取出的试验菌株接种BHI,37 ℃过夜活化后划线接种BHA平板培养并挑取单菌落
|
|
表3ASO-PCR引物序列
Table 3ASO-PCR primers
|
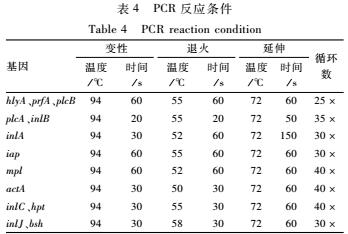
纯培养;然后将BHA平板上的纯菌转入含600 μl灭菌超纯水的Eppendorf管中混匀,100 ℃水浴10 min后吸取上清作为DNA模板,-20 ℃保存。再进行PCR扩增反应。PCR反应条件为94 ℃预变性240 s,变性、退火、延伸温度、时间及循环数见表4。感染相关基因序列见表5。
2结果
2.1即食食品菌株血清型分布特征
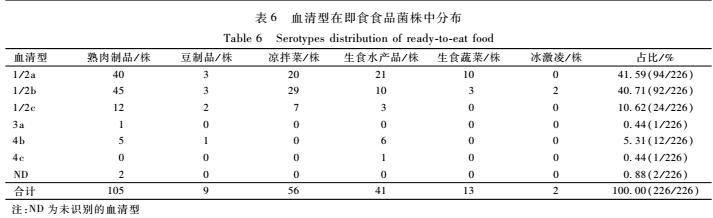
即食食品菌株血清型总体分布特征如表6所示,血清型主要分为1/2a、1/2b、1/2c和4b,另外还
|
表4PCR反应条件
Table 4PCR reaction condition
|

|
表5感染相关基因序列
Table 5Virulence-associated genes primers
|
|
表6血清型在即食食品菌株中分布
Table 6Serotypes distribution of ready-to-eat food
注:ND为未识别的血清型 |
分离到1株3a菌株和1株4c菌株。其中1/2a和1/2b是分离率最高的血清型,分别为41.59%和40.71%;其次是1/2c和4b分别为10.62%和5.31%。不同种类即食食品分离得到的菌株分布特征与总体分布差别不大,但菌株含量少的食品种类只含有部分优势血清型。其中4b菌株主要由分离自生食水产品和熟肉制品的菌株构成。
2.2即食食品菌株谱系分布特征
即食食品菌株谱系分布详见表7,主要以谱系I和谱系II为主,两个谱系分布差别不大,谱系III分布极少,只有生食水产品血清型为谱系III。熟肉制品血清型在两个谱系中所占比例最高,不同食物来源的菌株谱系分布情况与即食食品总体情况相似。谱系分析ASO-PCR电泳图见图1。
2.3感染相关基因检测结果
感染相关基因结果显示,prfA缺失3株,检出率为98.67%(223/226);plcA缺失3株,检出率为98.67%(223/226);actA检出率为97.79%(221/226),
|
|
表7谱系在即食食品菌株中分布
Table 7Lineage distribution of ready-to-eat strains
|
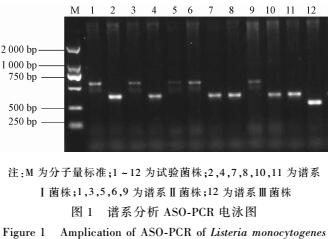
|
注:M为分子量标准;1~12为试验菌株;2,4,7,8,10,11为谱系
Ⅰ菌株;1,3,5,6,9为谱系Ⅱ菌株;12为谱系Ⅲ菌株
图1谱系分析ASO-PCR电泳图
Figure 1Amplication of ASO-PCR of Listeria monocytogenes
|
|
表8感染相关基因缺失状况
Table 8Results of virulence gene deletion of foodborne
Listeria monocytogenes
|
2.4感染相关基因与血清型关系
即食食品中单增李斯特菌感染相关基因缺失株比例与血清型分布比例相近,单增李斯特菌感染相关基因缺失15株,主要为凉拌菜、熟肉制品和生食水产品。15株中有7株为1/2b菌株,6株为1/2a,4b和1/2c各有1株。
3讨论
根据菌体/鞭毛抗原(O/H)的血清学反应,李斯特菌可分为16个血清型,单增李斯特菌的血清型为1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e或7型。最常见的与人类患病有关的血清型为1/2a、1/2b和4b。所有与李斯特菌相关的血清型中,有50%的李斯特菌病由4b菌株引起[9]。
本研究血清学分型结果显示,6类即食食品中生食水产品菌株致病性血清型比例高达90.24%(37/41)。生食水产品为不经烹调,直接入口的即食食品,加工处理过程的各个环节均有可能被单增李斯特菌污染,一旦污染则引起疾病的机会就会增加。其次是熟肉制品和凉拌菜,菌株致病性血清型分别占85.71%(90/105)和87.50%(49/56),熟肉制品因其即食性、为保持其风味而食用前不加热的特点决定了此类食品易被单增李斯特菌污染。凉拌菜为直接入口的生食类蔬菜,一般放在冷藏柜保存。由于单增李斯特菌嗜冷特性,其在冷藏条件下能大量繁殖并引起食源性疾病[10]。因此冷藏柜应定期清洗消毒,避免交叉污染,对冰箱存放食品需加热后再食用。生的动物性食品需要彻底加热,生食蔬菜食用前要彻底清洗,未加工的肉类与蔬菜、已加工的食品和即食食品要分开,加工食品后的手、刀和砧板要分别清洗。6类即食食品中,冰激凌采集于卫生操作程序较规范的冷饮快餐店且采集数量少,所以检出血清型致病率较低。有研究发现[11],肉制品和海产品最容易感染单增李斯特菌,而乳制品污染的危险性较小,在冰激凌类食品中存在少量单增李斯特菌污染。
李斯特菌又可分为3个谱系,谱系I包括1/2b、3b、3c和4b,人源分布比例较高;谱系Ⅱ包括1/2a、1/2c和3a,在食品和自然环境中分离比例较高;谱系III包括4a、4c和一部分不典型4b血清型菌株,大部分来源于反刍动物[12]。绝大部分单增李斯特菌属于谱系Ⅰ和谱系Ⅱ。全球李斯特菌病暴发主要与谱系Ⅰ中的4b菌株相关,少数与1/2a和1/2b有关[13-14]。226株即食食品中分离得到的菌株谱系I和谱系II分别为46.46%(105/226)和53.10%(120/226),其中1/2a和1/2b是分离率最高的血清型,分别为41.59%(94/226)和40.71%(92/226),其次是1/2c(10.62%,24/226)和4b(5.31%,12/226),与本研究分离自不同食物种类中的血清型分布相比,1/2b菌株比例较高。即食食品菌株血清型分布结果提示我国即食食品单增李斯特菌感染风险较高。由于即食食品是引起李斯特菌病的高危食品,且能够在低温中繁殖,考虑我国目前的卫生状况,致病菌繁殖几率较大,应加强食品卫生管理。
单增李斯特菌感染过程中的每一步均有特定的毒力基因编码的蛋白质精确调控。 国外对单增李斯特菌研究较多的毒力基因有溶血素(LLO)、磷脂酶、内化素、肌动蛋白、毒力因子调节蛋白和P60蛋白等。LLO是单增李斯特菌的重要毒力因子,由hly基因编码。研究表明[15],LLO与单增李斯特菌的致病性密切相关,有致病性的单增李斯特菌有LLO,无致病性的单增李斯特菌没有LLO。PrfA的调控可以是正调控,也可以是负调控,均抑制毒力因子调节蛋白的表达[16]。在感染宿主细胞的过程中,对许多毒力因子的表达起到了关键的调控作用[17]。本研究用PCR方法对单增李斯特菌的两个毒力岛的12种基因进行检测(prfA,plcA,hpt,hly,mpl,actA,plcB,inlA,inlB,inlC,inlJ,bsh),结果显示,actA缺失率最高为2.26%(5/226),其次是prfA、plcA均为1.32%(3/226),而hly、plcB、mpl、inlC、iap、hpt缺失率为零。表明我国即食食品中单增李斯特菌菌株的毒力缺失情况并不严重,只有个别菌株缺失感染相关基因。可能与毒力基因在单增李斯特菌中有较强的保守性有关,而且我国即食食品株主要以毒力较强的谱系Ⅰ和谱系Ⅱ为主。通过PCR检测已知的毒力也只能作为潜在毒力的基础研究,远远不能建立起确认致病性的方法。随着研究的深入,将会发现更多的毒力因子,并进一步了解它们的功能从而给李斯特菌病的防治带来深远影响。
虽然我国即食食品单增李斯特菌感染的风险较高,但我国报告的该菌感染的流行病资料非常缺乏,主要有3个方面原因:①构成单增李斯特菌的关键因素之一是食物带菌量,在污染食物中可能因达不到感染量而不引起疾病;②医院缺乏对该菌的重视和快速准确的检测方法,对可疑病人滥用抗生素也会导致不能检出病原菌;③该菌的大规模暴发如果缺乏完善的溯源和监测系统,会很难被发现。需要进一步结合动物模型试验、体外试验以及流行病学数据,建立更准确全面的单增李斯特菌致病性评价方法,为我国食源性单增李斯特菌风险评估提供更全面、更准确的数据和依据。
参考文献
[1]王海燕,刘中学,刘虹,等.食品中单增李斯特菌快速、敏感、特异PCR检测方法的建立[J].检验检疫科学,2006,16(1):3-6.
[2]CDC.Multistate outbreak of listeriosis linked to whole Cantaloupes from Jensen Farms, Colorado[EB/OL].(2013-09-04)[2016-06-28].http://www.cdc.gov/listeria/outbreaks/cantaloupes-jensen-farms/082712/index.html.
[3]新华网.食物污染导致丹麦24人感染李斯特菌[EB/OL].(2014-08-18)[2016-06-28].http://news.xinhuanet.com/2014-08/18/c_1112127148.htm.
[4]张丽萍,张克俭,高涛,等.食源性单增李斯特菌血清分型及耐药性的研究[J].实用预防医学,2013,20(5):611-613.
[5]曾静,魏海燕,张西萌,等.进口三文鱼单核细胞增生李斯特菌污染检测[J].中国公共卫生,2008,24(8):1003-1004.
[6]张淑红,侯凤伶,关文英,等.2005—2013年河北省即食食品中单增李斯特菌污染及耐药特征研究[J].中国食品卫生杂志,2014,26(6):596-599.
[7]马爱静,王艳,王毅,等.北京市一些地区生肉标本中单增李斯特菌的分离及其分子流行病学特征分析[J].中国人兽共患病学报,2015,31(5):403-407.
[8]Ward T J,Gorski L,Borucki M K,et al.Intraspecific phylogeny and lineage group identification based on the prfA virulence gene cluster of Listeria monocytogenes[J].Journal of Bacteriology,2004,186(15):4994-5002.
[9]吴雁军,曹亢,郭慧媛,等.单增李斯特菌检测方法的最新研究进展[J].中国乳业,2011,112(4):38-42.
[10]崔京辉,李达,王永全,等.2004—2005年北京市食品中单核细胞增生性李斯特菌的污染状况调查[J].中国卫生检验杂志,2006,16(12):1508-1509.
[11]吴蜀豫,李迎惠,冉陆,等.中国2001年11省(市)食品中李斯特菌污染状况的主动监测[J].中华流行病学杂志,2003,24(8):657-660.
[12]Orsi R H,Bakker H C D, Wiedmann M.Listeria monocytogenes lineages:genomics, evolution, ecology, and phenotypic characteristics[J].International Journal of Medical Microbiology Ijmm,2011,301(2):79-96.
[13]Hong E,Doumith M,Duperrier S,et al.Genetic diversity of Listeria monocytogenes recovered from infected persons and pork, seafood and dairy products on retail sale in France during 2000 and 2001[J].International Journal of Food Microbiology,2007,114(2):187-194.
[14]Valk H D,Vaillant V,Goulet V.Epidemiology of human listeriosis in France [J].Bulletin De Lacadémie Nationale De Médecine,2000,184(2):267-274.
[15]Decatur A L,Portnoy A.A PEST-like sequence in listeriolysin O essential for Listeria monocytogenes pathogenicity[J].Science,2000,290(5493):992-995.
[16]江铃丽,陈健舜,方维焕.单核细胞增多性李斯特菌主要毒力因子研究进展[J].中国人兽共患病学报,2007,23(7):733-735.
[17]Wong K K,Freitag N E.A novel mutation within the central Listeria monocytogenes regulator prfA that results in constitutive expression of virulence gene products[J].Journal of Bacteriology,2004,186(18):6265-6276.
[2]CDC.Multistate outbreak of listeriosis linked to whole Cantaloupes from Jensen Farms, Colorado[EB/OL].(2013-09-04)[2016-06-28].http://www.cdc.gov/listeria/outbreaks/cantaloupes-jensen-farms/082712/index.html.
[3]新华网.食物污染导致丹麦24人感染李斯特菌[EB/OL].(2014-08-18)[2016-06-28].http://news.xinhuanet.com/2014-08/18/c_1112127148.htm.
[4]张丽萍,张克俭,高涛,等.食源性单增李斯特菌血清分型及耐药性的研究[J].实用预防医学,2013,20(5):611-613.
[5]曾静,魏海燕,张西萌,等.进口三文鱼单核细胞增生李斯特菌污染检测[J].中国公共卫生,2008,24(8):1003-1004.
[6]张淑红,侯凤伶,关文英,等.2005—2013年河北省即食食品中单增李斯特菌污染及耐药特征研究[J].中国食品卫生杂志,2014,26(6):596-599.
[7]马爱静,王艳,王毅,等.北京市一些地区生肉标本中单增李斯特菌的分离及其分子流行病学特征分析[J].中国人兽共患病学报,2015,31(5):403-407.
[8]Ward T J,Gorski L,Borucki M K,et al.Intraspecific phylogeny and lineage group identification based on the prfA virulence gene cluster of Listeria monocytogenes[J].Journal of Bacteriology,2004,186(15):4994-5002.
[9]吴雁军,曹亢,郭慧媛,等.单增李斯特菌检测方法的最新研究进展[J].中国乳业,2011,112(4):38-42.
[10]崔京辉,李达,王永全,等.2004—2005年北京市食品中单核细胞增生性李斯特菌的污染状况调查[J].中国卫生检验杂志,2006,16(12):1508-1509.
[11]吴蜀豫,李迎惠,冉陆,等.中国2001年11省(市)食品中李斯特菌污染状况的主动监测[J].中华流行病学杂志,2003,24(8):657-660.
[12]Orsi R H,Bakker H C D, Wiedmann M.Listeria monocytogenes lineages:genomics, evolution, ecology, and phenotypic characteristics[J].International Journal of Medical Microbiology Ijmm,2011,301(2):79-96.
[13]Hong E,Doumith M,Duperrier S,et al.Genetic diversity of Listeria monocytogenes recovered from infected persons and pork, seafood and dairy products on retail sale in France during 2000 and 2001[J].International Journal of Food Microbiology,2007,114(2):187-194.
[14]Valk H D,Vaillant V,Goulet V.Epidemiology of human listeriosis in France [J].Bulletin De Lacadémie Nationale De Médecine,2000,184(2):267-274.
[15]Decatur A L,Portnoy A.A PEST-like sequence in listeriolysin O essential for Listeria monocytogenes pathogenicity[J].Science,2000,290(5493):992-995.
[16]江铃丽,陈健舜,方维焕.单核细胞增多性李斯特菌主要毒力因子研究进展[J].中国人兽共患病学报,2007,23(7):733-735.
[17]Wong K K,Freitag N E.A novel mutation within the central Listeria monocytogenes regulator prfA that results in constitutive expression of virulence gene products[J].Journal of Bacteriology,2004,186(18):6265-6276.
 马彦宁,赵悦,郭云昌,卓勤.即食食品中单核细胞增生李斯特菌的血清学分型和毒力基因分析[J].中国食品卫生杂志,2017,29(1):14-18.
马彦宁,赵悦,郭云昌,卓勤.即食食品中单核细胞增生李斯特菌的血清学分型和毒力基因分析[J].中国食品卫生杂志,2017,29(1):14-18.