DOi:10.13590/j.cjfh.2017.01.003
GII.3型诺如病毒重组衣壳蛋白的表达和纯化鉴定
(国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021)
江涛男研究员研究方向为食品卫生
收稿日期: 2017-01-04
基金项目: 北京市自然科学基金(No.5141002)
摘要:目的 通过杆状病毒表达系统,获取高纯度GII.3型诺如病毒重组衣壳蛋白,为制备抗GII.3型诺如病毒单克隆和多克隆抗体提供免疫原。方法将GII.3型诺如病毒衣壳蛋白基因片段修饰后插入pHTA表达载体中,经测序鉴定,将鉴定正确的重组质粒转化到MAX Efficiency DH10BacTM感受态细胞中,获取表达杆粒并转染SF9细胞,表达GII.3型诺如病毒重组衣壳蛋白。重组蛋白用Ni-NTA His蛋白亲和柱纯化,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白免疫印迹(Western blot)方法鉴定。结果SDS-PAGE和Western blot结果表达了分子量约为60 kDa的重组蛋白,动物试验表明重组蛋白具有较好的免疫原性,为制备抗GII.3型诺如病毒单克隆抗体和多克隆抗体、建立相应的免疫学检测方法奠定了基础。结论构建了GII.3型诺如病毒衣壳蛋白表达载体,并获得GII.3型诺如病毒重组衣壳蛋白。
关键词:
重组蛋白; GII.3型诺如病毒; 杆状病毒表达系统; 表达; 纯化; 鉴定; 食品污染物; 食品安全
文章编号:1004-8456(2017)01-0009-05 中图分类号: R155.5 文献标识码:A
The expression, purification and identification of Norovirus GII.3 capsid protein
(Key Laboratory of Food Safety Risk Assessment of Ministry of Health,China National Center for Food Safety Risk Assessment,Beijing 100021,China)
Abstract:Objective To express the Norovirus GII.3 capsid protein by gene recombination. MethodsThe Norovirus GII.3 capsid protein gene was modified and inserted into the pHTA plasmid. The recombinant plasmid was transformed into the MAX Efficiency DH10BacTM competent cell after sequencing and the expression plasmid was obtained. The plasmid was transformed into SF9 cell, and the recombinant capsid protein was expressed. The recombinant capsid protein was purified by Ni-NTA His affinity chromatography purification column followed by identification with sodium dodecyl sufate polyacrylamide gel electrophoresis and Western blot. ResultsThe recombinant capsid protein of about 60 kDa was expressed. It had good immunogenicity, which was verified by animal experiments. The recombinant capsid protein made it possible to prepare monoclonal antibody against Norovirus GII.3 and to develop the immunology detection method.ConclusionThe Norovirus GII.3 capsid protein expression plasmid was constructed and the recombinant capsid protein was expressed.
Key words:
Recombinant protein; Norovirus GII.3; Baculovirus expression system; expression; purification; identification;food contaminants; food safety
诺如病毒(Norovirus,NoV)属于杯状病毒科诺如病毒属,是一种单链RNA病毒,主要污染牡蛎等贝类产品。NoV传播途径有多种,进食被NoV污染的食物是重要途径之一[1],此外,NoV也可通过被污染的水、物品、气溶胶等传播,常在社区、学校、餐馆、医院、托儿所、孤老院及军营等封闭或半封闭场所引起疾病暴发[2]。据不完全统计,美国每年由NoV引起的感染病例约有2 300万[3],这一情况在发展中国家更为严重,该病毒在发展中国家每年可引起约100万儿童感染,20万儿童死亡[4]。2012年以来,NoV已成为我国除细菌外其他感染性腹泻病暴发的主要病原体,感染率可达60%~96%,尤其2014年冬季以来,该病毒引起的暴发事件大幅度上升,仅2015年1月1日~11月15日通过突发公共卫生事件管理系统上报的由NoV引起的食源性疾病就有88起,主要发生在中小学校等集体场所,严重危害消费者健康[5]。由于NoV在食品中含量低,且食品中干扰病毒检测的物质较多,因此,对食品中NoV颗粒的富集和纯化是病毒检测的关键[6-8]。目前对NoV的富集和纯化方法主要有聚乙二醇(PEG)沉淀法和利用带正电的超顺磁珠捕获样品中带负电的病毒颗粒的阳离子磁珠富集法[9]。后者在富集带负电荷NoV的同时,也会使基质中其他一些带负电荷的蛋白同时沉淀下来,从而影响检测结果的灵敏度。近年来,基于抗原抗体特异性结合的免疫磁珠方法可特异性的富集样品中的NoV,提高检测方法的灵敏度和特异性[10],但其前提是要获得NoV衣壳蛋白并进一步制备抗NoV衣壳蛋白的单克隆或多克隆抗体。 NoV主要有GI~GV 5个基因组,各基因组内又有不同的基因型[11-12]。目前我国流行的基因型主要为GII.4型,其次为GII.3和GII.5型。2003—2012年间,Zhirakovskaia等[13]收集了1 098份儿童急性腹泻病例样本,其中NoV的检出率为13.1%,在NoV的检出病例中,GII.3型占51%,因此GII.3型正逐渐成为主要流行株。鉴于NoV目前很难进行体外培养,利用杆状病毒表达系统表达重组的NoV样颗粒,具有与天然病毒粒子相同的结构和性质,可以替代天然病毒粒子用于免疫原的制备。本研究旨在通过杆状病毒表达系统,获取高纯度GII.3型NoV重组衣壳蛋白,为制备抗GII.3型NoV单克隆和多克隆抗体提供免疫原,并利用制备的抗体建立检测GII.3型NoV的酶联免疫吸附(ELISA)方法、制备免疫磁珠,对食品中的NoV进行提取、分离与富集。
T4 DNA连接酶、限制性内切酶EcoRⅠ、XhoⅠ均购自NEB(北京)公司,大肠埃希菌[宝生物工程(大连)有限公司],质粒提取试剂盒、杆状病毒表达系统、MAX EfficiencyDH10BacTM感受态细胞、SF9细胞、His标签蛋白纯化试剂盒、辣根过氧化物酶(HRP)标记的抗His标签抗体均购自英潍捷基(上海)贸易有限公司,胶回收试剂盒、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)均购自天根生化科技(北京)有限公司,肉汤(LB)培养基、LB琼脂均购自北京陆桥技术股份有限公司,预染蛋白Marker、ELC化学发光底物均购自美国Fermentas,其他化学试剂均购自北京化工厂。
1材料与方法
1.1主要仪器与试剂
凝胶成像系统(美国Bio-Rad)、电子天平、微量核酸蛋白测定仪(美国NanoDrop)、恒温培养箱、恒温水浴锅、水平摇床、离心机、电泳装置、全温摇床。T4 DNA连接酶、限制性内切酶EcoRⅠ、XhoⅠ均购自NEB(北京)公司,大肠埃希菌[宝生物工程(大连)有限公司],质粒提取试剂盒、杆状病毒表达系统、MAX EfficiencyDH10BacTM感受态细胞、SF9细胞、His标签蛋白纯化试剂盒、辣根过氧化物酶(HRP)标记的抗His标签抗体均购自英潍捷基(上海)贸易有限公司,胶回收试剂盒、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)均购自天根生化科技(北京)有限公司,肉汤(LB)培养基、LB琼脂均购自北京陆桥技术股份有限公司,预染蛋白Marker、ELC化学发光底物均购自美国Fermentas,其他化学试剂均购自北京化工厂。
1.2方法
1.2.1重组ORF2杆粒的构建
根据杆状病毒表达基因偏好性,修饰GII.3型NoV的ORF2基因,在两端分别引入EcoRⅠ和XhoⅠ限制性内切酶位点,由英潍捷基(上海)贸易有限公司进行序列合成。将合成的质粒用EcoRⅠ和XhoⅠ进行双酶切,同时将表达载体pFastBac HTA进行双酶切。将二者酶切产物用T4 DNA连接酶连接,转化到大肠埃希菌感受态细胞JM109中,命名为pFB HTA-GII.3 JM109,转化后的菌液涂布于含有100 μg/ml 氨苄青霉素的LB平板上,37 ℃培养14 h。挑取单克隆菌落接种于含100 μg/ml氨苄青霉素的LB培养基中,37 ℃ 220 r/min培养过夜后,测序鉴定。将测序正确的菌液提取质粒,所得质粒转化到MAX Efficiency DH10BacTM感受态细胞中,将转化后的菌液涂布于含有7 μg/ml庆大霉素、50 μg/ml卡那霉素、10 μg/ml四环素、100 μg/ml X-Gal、40 μg/ml IPTG的LB琼脂上,37 ℃培养48 h。挑取白色菌落,再次涂布于上述培养基,37 ℃过夜培养,将仍然为白色的单菌落接种于含有7 μg/ml庆大霉素、50 μg/ml卡那霉素、10 μg/ml四环素的LB中,37 ℃ 220 r/min过夜培养后,进行PCR鉴定。
1.2.2重组杆状病毒的构建
PCR验证正确的菌株提取杆粒,根据Cellfectin II Reagent转染试剂说明书,将杆粒转染SF9细胞,获得病毒储藏液,命名为GII.3 P1。将GII.3 P1病毒储藏液接种新鲜的SF9细胞,获得2代病毒储藏液,命名为GII.3 P2,用噬斑法测定病毒滴度。
1.2.3重组蛋白表达条件的优化
以感染复数(multiplicity of infection,MOI)为1,将重组杆状病毒接种新鲜的SF9细胞,分别于24、48、72、96、120 h取少量细胞悬液,1 500 r/min离心10 min收集细胞,向细胞内加入十二烷基硫酸钠聚丙烯酰胺(SDS)缓冲液,反复冻融2次后,1 500 r/min离心10 min取上清进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。确定重组蛋白的分子量并选择确认表达量最高的时间点,收集细胞。
1.2.4表达产物的纯化
pFastBac HTA载体前段有His标签,针对这一特性,本试验选用His标签蛋白纯化试剂盒,利用试剂盒中提供的Ni-NTA His蛋白亲和柱进行重组蛋白。
1.2.5GII.3型NoV重组衣壳蛋白的鉴定
采用蛋白免疫印迹(Western blot)方法对GII.3型NoV重组衣壳蛋白进行鉴定。具体为SDS-PAGE电泳后,将胶块卸下,按照负极-滤纸-胶-膜-滤纸-正极的顺序将胶块夹好,400 mA转印1 h。以鼠抗His单抗为一抗,HRP标记的山羊抗小鼠抗体为二抗进行反应,加入显色液进行显色。
1.2.6重组衣壳蛋白免疫原性的鉴定
以100 μg/只的免疫量对3只8周龄Balb/c小鼠进行免疫,免疫间隔为2周,3次免疫后,取小鼠血清。将纯化后的GII.3型NoV重组衣壳蛋白以0.5 μg/孔的蛋白包被量包被酶标板,小鼠血清从1∶200开始进行倍比稀释,加入酶标板中,以1∶5 000 稀释的HRP标记的山羊抗小鼠抗体作为二抗,加入底物显色后,在450 nm波长下测定吸光度(OD)。
2结果与分析
2.1重组表达载体的构建
将目的片段与表达载体连接后,转化到JM109感受态细胞中,经含氨苄青霉素的LB培养基筛选后进行测序验证,结果表明插入片段正确。
2.2重组杆粒的构建
将测序正确的重组表达载体转化到MAX Efficiency DH10BacTM感受态细胞中,经含庆大霉素、卡那霉素、四环素、X-Gal及IPTG培养基筛选,进行PCR验证,结果如图1。由图1可见,待测扩增产物在约1 700 bp处有一明显条带,扩增条带片段大小符合目的片段大小。
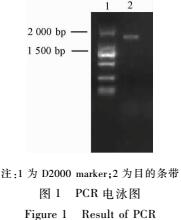
|
注:1为D2000 marker;2为目的条带
图1PCR电泳图
Figure 1Result of PCR
|
2.3重组蛋白的表达及条件优化
将杆粒转染SF9细胞,获得1代杆状病毒GII.3 P1,将该病毒接种新鲜的SF9细胞,获得2代杆状病毒GII.3 P2,利用噬斑法测定病毒滴度,结果为1.2×108 PFU/ml。以MOI=1接种新鲜的SF9细胞,分别于24、48、72、96和120 h收集细胞并进行SDS-PAGE电泳,结果见图2。由图2可见,96 h时,重组蛋白表达达到高峰,且在60 kDa处有明显蛋白条带,因此后续试验中选择96 h为最终表达时间。

|
注:1为protein marker;2~6分别为24、48、72、96、120 h的
细胞裂解液
图2表达时间对重组蛋白表达量的影响
Figure 2Impact of expression time on the expression level
of recombinant capsid protein of GII.3
|
2.4重组蛋白的鉴定
利用Westernblot方法对表达的重组蛋白进行鉴定,结果见图3。由图3可见,膜上有一条明显的特异性条带,经比对大小与目的条带相当。
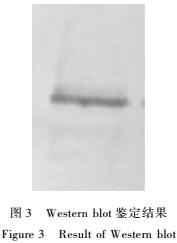
|
图3Western blot鉴定结果
Figure 3Result of Western blot
|
2.5重组蛋白的纯化
利用试剂盒对表达的蛋白进行纯化,纯化后产物进行SDS-PAGE电泳,结果见图4。由图4可见,纯化后的重组蛋白在60 kDa处有一明显条带。
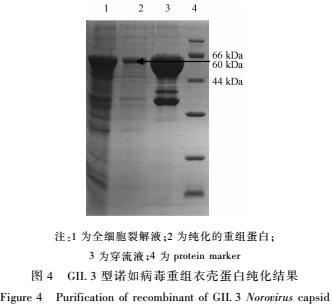
|
注:1为全细胞裂解液;2为纯化的重组蛋白;
3为穿流液;4为protein marker
图4GII.3型诺如病毒重组衣壳蛋白纯化结果
Figure 4Purification of recombinant of GII.3 Norovirus capsid
|
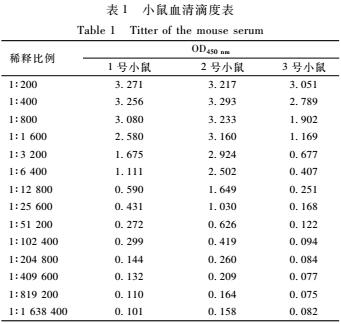
2.6GII.3型NoV重组衣壳蛋白免疫原性的鉴定
GII.3型NoV重组衣壳蛋白免疫原性鉴定结果如表1所示,ELISA临界值大于0.18即为阳性。选择大于0.18的最大稀释倍数作为小鼠的血清滴度。结果显示,3只小鼠的血清抗体滴度分别为1∶102 400、1∶409 600和1∶12 800。
|
表1小鼠血清滴度表
Table 1Titter of the mouse serum
|
3讨论
NoV是世界范围内引起急性病毒性胃肠炎的主要病原体[14],由NoV导致的感染性腹泻在全世界范围内均有流行。在美国,NoV平均每年可以引起1 900万人~2 100万人发病,导致800例死亡和71 000例住院[15]。我国每年由NoV引起的聚集性腹泻暴发案例逐年攀升,2014年仅北京市就发现NoV聚集性疫情39起,807例病例,涉及23所幼儿园、15所小学、1所大学,严重危害消费者健康[16]。
本试验采用杆状病毒表达系统,该系统属于真核表达系统,由于野生型NoV衣壳蛋白基因的密码子与杆状病毒表达系统真核细胞的密码子使用频率不同,因此需要将野生型NoV衣壳蛋白的部分密码子进行替换,以期提高蛋白表达量,本试验根据杆状病毒表达的基因偏好性,对GII.3型NoV衣壳蛋白ORF2基因进行修饰并人工合成,修改后的基因片段连接到HTA表达载体上,转化到MAX Efficiency DH10BacTM感受态细胞中,并获得了表达杆粒。利用转染试剂盒将所得杆粒转染到SF9细胞上,并进行传代,获得了表达GII.3型NoV重组衣壳蛋白的杆状病毒。所获蛋白经Westernblot鉴定,在60 kDa有明显条带,与预期结果相符合。本试验中,由于缺乏针对抗GII.3型NoV的抗体,因此Westernblot鉴定选用抗His标签抗体,与SDS-PAGE电泳图进行比对后,重组蛋白大小符合预期设想。将所获重组蛋白用His标签蛋白Ni-NTA亲和柱进行纯化,纯化后最终获得较高纯度的GII.3型NoV重组衣壳蛋白。
GII.3型NoV重组衣壳蛋白的纯化对后续制备抗GII.3型NoV单克隆抗体和建立ELISA检测方法至关重要。纯化过程中存在重组蛋白的流失,穿流液中可能含有大量目的蛋白,这可能与上样量有一定关系,在试验中,可将穿流液收集后再次上样,以提高重组蛋白的纯化效率。将纯化后的重组蛋白免疫小鼠,3次免疫后,小鼠血清中可检测到针对重组蛋白的高滴度抗体,说明重组蛋白具有良好的免疫原性,可用于后续单克隆抗体和多克隆抗体的制备,为获得抗GII.3型NoV单克隆抗体、制备用于分离和富集食品中GII.3型NoV的免疫磁珠奠定良好的基础。此外,本试验中所获得的NoV样颗粒,可作为包被抗原直接包被酶标板,用于检测人血清中抗GII.3型NoV抗体,调查人群中GII.3型NoV的感染情况,为NoV流行病学调查提供数据支持。
参考文献
[1]Cheng P K,Wong D K,Chung T W,et al.Norovirus contamination found in oysters worldwide[J].J Med Microbiol,2005,76(4):593-597.
[2]Glatzer M B.Internal reports on shellfish-born disease outbreaks, 1992-1998[M].Atlanta:US Food and Drug Administration,Southeast Regional Office,1998.
[3]Mead P S,Slutsker L,Dietz V,et al.Food-related illness and death in the United States[J].Emerging Infectious Diseases,1999,5(5):607-625.
[4]Patel M M,Widdowson M A,Glass R I,et al.Systematic literature review of role of Noroviruses in sporadic gastroenteritis[J].Emerg Infect Dis,2008,14(8):1224-1231.
[5]廖巧红,冉陆,靳淼,等,诺如病毒感染暴发调查和预防控制技术指南(2015年版)[J].中华预防医学杂志,2016,50(1):7-16.
[6]中华人民共和国国家质量监督检验检疫总局.SN/T 2626—2010 国境口岸诺如病毒检测方法[S].北京:中国标准出版社,2010.
[7]中华人民共和国国家质量监督检验检疫总局.SN/T 2730—2010 进出口食品中诺如病毒检测 酶联免疫吸附法[S].北京:中国标准出版社,2010.
[8]中华人民共和国国家质量监督检验检疫总局.SN/T 1635—2005 贝类中诺沃克病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法[S].北京:中国标准出版社,2005.
[9]李楠,王佳慧,李凤琴,等.检测鲜草莓中GII型诺如病毒的两种富集方法比较[J].中国食品卫生杂志,2015,27(3):242-245.
[10]黄艳梅,刘道峰,赖卫华,等.集成免疫磁珠富集和免疫层析的黄曲霉毒素M1快速检测法[J].分析化学,2015,42(5):654-659.
[11]Koroneman A,Vega E,Vennema H,et al.Proposal for a unified Norovirus nomenclature and genotyping[J].Arch Virol,2013,158(10):2059-2068.
[12]Donaldson E,Lindesmith L,Lobue A,et al.Norovirus pathogenesis:mechanisms of persistence and immune evasion in human populations[J].Immunol Rev,2008,225(1):190-211.
[13]Zhirakovskaia E V,Tikunov A Y,Bodnev S A,et al.Molecular epidemiology of Noroviruses associated with sporadic gastroenteritis in children in Novosibirsk, Russia, 2003-2012[J].J Med Virol,2015,87(5):740-753.
[14]Kapikian A,Wyatt R,Dolin R,et al.Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis[J].J Virol,1972,10(5):1075-1081.
[15]Hall A J,Lopman B A,Payne D C,et al.Norovirus disease in the United States[J].Emerg Infect Dis, 2013,19(8):1198-1205.
[16]北京疾控中心:今年共发现诺如病毒聚集性病例39起[EB/OL].(2014-12-23)[2016-09-02]http://www.cnfood.cn/n/2014/1223/42150.html.
[2]Glatzer M B.Internal reports on shellfish-born disease outbreaks, 1992-1998[M].Atlanta:US Food and Drug Administration,Southeast Regional Office,1998.
[3]Mead P S,Slutsker L,Dietz V,et al.Food-related illness and death in the United States[J].Emerging Infectious Diseases,1999,5(5):607-625.
[4]Patel M M,Widdowson M A,Glass R I,et al.Systematic literature review of role of Noroviruses in sporadic gastroenteritis[J].Emerg Infect Dis,2008,14(8):1224-1231.
[5]廖巧红,冉陆,靳淼,等,诺如病毒感染暴发调查和预防控制技术指南(2015年版)[J].中华预防医学杂志,2016,50(1):7-16.
[6]中华人民共和国国家质量监督检验检疫总局.SN/T 2626—2010 国境口岸诺如病毒检测方法[S].北京:中国标准出版社,2010.
[7]中华人民共和国国家质量监督检验检疫总局.SN/T 2730—2010 进出口食品中诺如病毒检测 酶联免疫吸附法[S].北京:中国标准出版社,2010.
[8]中华人民共和国国家质量监督检验检疫总局.SN/T 1635—2005 贝类中诺沃克病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法[S].北京:中国标准出版社,2005.
[9]李楠,王佳慧,李凤琴,等.检测鲜草莓中GII型诺如病毒的两种富集方法比较[J].中国食品卫生杂志,2015,27(3):242-245.
[10]黄艳梅,刘道峰,赖卫华,等.集成免疫磁珠富集和免疫层析的黄曲霉毒素M1快速检测法[J].分析化学,2015,42(5):654-659.
[11]Koroneman A,Vega E,Vennema H,et al.Proposal for a unified Norovirus nomenclature and genotyping[J].Arch Virol,2013,158(10):2059-2068.
[12]Donaldson E,Lindesmith L,Lobue A,et al.Norovirus pathogenesis:mechanisms of persistence and immune evasion in human populations[J].Immunol Rev,2008,225(1):190-211.
[13]Zhirakovskaia E V,Tikunov A Y,Bodnev S A,et al.Molecular epidemiology of Noroviruses associated with sporadic gastroenteritis in children in Novosibirsk, Russia, 2003-2012[J].J Med Virol,2015,87(5):740-753.
[14]Kapikian A,Wyatt R,Dolin R,et al.Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis[J].J Virol,1972,10(5):1075-1081.
[15]Hall A J,Lopman B A,Payne D C,et al.Norovirus disease in the United States[J].Emerg Infect Dis, 2013,19(8):1198-1205.
[16]北京疾控中心:今年共发现诺如病毒聚集性病例39起[EB/OL].(2014-12-23)[2016-09-02]http://www.cnfood.cn/n/2014/1223/42150.html.
 王佳慧,李凤琴,李楠,韩春卉,江涛.GII.3型诺如病毒重组衣壳蛋白的表达和纯化鉴定[J].中国食品卫生杂志,2017,29(1):9-13.
王佳慧,李凤琴,李楠,韩春卉,江涛.GII.3型诺如病毒重组衣壳蛋白的表达和纯化鉴定[J].中国食品卫生杂志,2017,29(1):9-13.