DOi:10.13590/j.cjfh.2017.05.011
转基因鲑鱼AquAdvantage品系特异性实时荧光聚合酶链式反应检测方法的建立
(1.黄埔出入境检验检疫局,广东 广州 510730; 2.广东出入境检验检疫局 技术中心,广东 广州 510623)
作者简介:刘二龙 男 高级兽医师 研究方向为动植物检疫技术 E-mail:erlongliu@126.com
收稿日期:2017-05-05
基金项目:广东出入境检验检疫局科技项目(2017GDK41)
摘要: 目的 实现转基因鲑鱼AquAdvantage的标识管理,建立其品系特异性实时荧光聚合酶链式反应(PCR)检测方法。方法 针对转基因鲑鱼的品系特异性序列设计引物和TaqMan探针,建立转基因鲑鱼实时荧光PCR检测方法,并对该方法的特异性、灵敏度和重复性进行检测。结果 建立的转基因鲑鱼实时荧光PCR方法特异性强,在600 000~60拷贝范围内呈良好的线性关系,其线性回归方程为y=-3.2194x+40.805,R2=0.997,检测限为60拷贝,检测重复性良好。结论 建立的品系特异性实时荧光PCR方法可应用于转基因鲑鱼AquAdvantage的鉴定。
关键词:
转基因鲑鱼; AquAdvantage; 实时荧光聚合酶链式反应; 品系特异性; 检测
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)05-0576-05
Event-specific real-time polymerase chain reaction detection method of genetically modified
AquAdvantage salmon
AquAdvantage salmon
(1.Huangpu Entry-Exit Inspection and Quarantine Bureau,Guangdong Guangzhou 510730,China; 2.Guangdong Inspection and Quarantine Technology Center,Guangdong Guangzhou 510623,China)
Abstract:Objective For implementation of labeling regulations, an event-specific real-time polymerase chain reaction (PCR) method for the detection of genetically modified AquAdvantage salmon was established in this study. Methods Primers and TaqMan probe were designed based on the event-specific sequence of AquAdvantage salmon. The specificity, sensitivity and repeatability of the developed method were examined, respectively. Results The specificity test of this method showed it was specific to AquAdvantage salmon. The 600 000-60 copies range showed a good linear relationship with Ct values, and its linear regression equation was y=-3.2194x+40.805(R2=0.997). The limit of quantification(LOQ) was 60 copies and the repeatability was good. Conclusion This event-specific real-time PCR method was suitable for the identification of genetically modified AquAdvantage salmon.
Key words:
Transgenic salmon; AquAdvantage; real-time polymerase chain reaction; event-specific; detection
2015年11月16日美国食品药品管理局(FDA)发布公告确定水优鲑鱼(商品名AquAdvantage salmon,AAS)与非转基因鲑鱼一样安全,这标志着转基因鲑鱼获得美国权威机构的最终批准,依法可以商业销售及食用[1-3]。 转基因鲑鱼AAS由加拿大水丰(AquaBounty)公司研发,自1995年水丰公司致函美国FDA申请调查开始,到获得批准所花时间约二十年[2]。 AAS经由将构建的美洲绵鳚抗冻蛋白基因5’端启动子调控序列-大鳞大马哈鱼(王鲑)的生长激素蛋白编码区(opAFP-GHc2)显微注射到野生鲑鱼鱼卵研发而成,所使用的转基因片段来自大鳞大马哈鱼(王鲑)的生长激素蛋白编码区和美洲绵鳚抗冻蛋白基因启动子调控序列。转入重组生长激素基因的鲑鱼可在寒冷环境下仍然保持生长,使转基因鲑鱼达到上市规格的生长周期由3年缩短至18个月,大大降低了鲑鱼的养殖成本[4-6]。 转基因鲑鱼直接食用的安全性是人们关注的焦点,另外其生态安全性也值得重视:转基因鲑鱼可能与自然环境中的其他鱼种发生有性交配,导致转基因漂移到自然鱼中,影响物种遗传多样性,或产生其他的未知风险。目前对转基因产品多数国家均采用相应的标识管理制度[7-8],标识管理制度的建立和实施依赖于有效、准确的检测鉴定技术。品系特异性(转化事件特异性)聚合酶链式反应(event-specific PCR)检测的目标序列是外源插入序列与目的基因组间连接区,相较于筛选PCR(screening PCR)、基因特异性PCR(gene-specific PCR)和构建特异性PCR(construct-specific PCR)具有更高的特异性,能用于鉴定转基因具体品系(甚至是同一质粒转化的不同品系),是目前转基因产品品系检测鉴定最重要的方法[9]。本试验针对AAS插入的美洲绵鳚抗冻蛋白基因启动子区域与鲑鱼基因组DNA的5’端连接区序列,建立特异性强、灵敏度高和稳定性良好的实时荧光定量PCR检测方法,满足监管部门对其转基因鲑鱼AAS正确标识的需求。
PCR反应体系为20 μl,其中Premix Ex TaqTM 10 μl,ROX Reference Dye II 0.2 μl,DNA 模板2 μl,10 μmol/L 的Aqu-F、Aqu-R和探针Aqu-P按A、B和C三组配比添加,ddH2O补足体积。反应程序为95 ℃预变性30 s;95 ℃变性5 s、58或60 ℃退火延伸34 s,40个循环,于58或60 ℃退火延伸时收集荧光信号。A组Aqu-F、Aqu-R和探针Aqu-P体积分别配比分别为0.5、0.5、1 μl,B组为0.4、0.4、0.8 μl,C组为0.2、0.2、0.4 μl,即A组上游引物、下游引物和探针的终浓度分别为250、250和500 nmol/L,B组为200、200和400 nmol/L,C组为100、100和200 nmol/L。适宜的引物和探针浓度组合根据循环阈值(Ct值)、荧光强度和扩增曲线综合判定。
最后确定的20 μl反应体系如下:Premix Ex TaqTM 10 μl,ROX Reference Dye II 0.2 μl,10 μmol/L Aqu-F和Aqu-R各0.4 μl,探针Aqu-P 0.8 μl,DNA 模板2 μl和ddH2O 6.2 μl;反应程序为95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火延伸34 s,40个循环,于60 ℃收集荧光信号。
1 材料与方法
1.1 材料
1.1.1 样品
大西洋鲑鱼、赤鮸鱼、带鱼、金线鱼、龙虾、鲈鱼、乌鲳鱼、鲳鱼、帝王蟹、青口贝和白虾由本实验室收集储备。
1.1.2 主要仪器与试剂
ABI 7500和ABI 7500FAST实时荧光定量PCR仪(美国应用生物系统)、nanodrop2000c微量分光光度计(美国Thermo)、研磨机。 Wizard基因组DNA纯化试剂盒[普洛麦格(北京)生物技术有限公司];Primex Ex Taq(2×) for qPCR(大连宝生物工程有限公司);质粒DNA提取试剂盒(北京天根生化科技有限公司);引物和探针由上海闪晶分子生物科技有限公司合成,稀释成浓度为10 μmol/L的工作液使用。
1.2 方法
1.2.1 DNA提取
称取研磨后的100 mg鱼肉样品,使用Wizard基因组DNA纯化试剂盒提取DNA,每次DNA提取均设置提取空白对照,微量分光光度计测定浓度。
1.2.2 质粒构建
转基因鲑鱼内源生长激素(growth hormone,GH)和AAS品系特异性双基因阳性质粒[将GH基因的160 bp片段(如图1)和AAS的5’品系特异性边界序列的150 bp片段(如图2)构建到AmpR抗性的PUC57载体上,构建得到的质粒转入受体菌DH5a后-70 ℃保存。以下称AFP-Aqu质粒]为本实验室构建。
1.2.3 实时荧光PCR检测方法的建立与优化
根据转入的美洲绵鳚抗冻蛋白基因启动子区域与鲑鱼基因组5’端边界序列(位置如图3中A处所示),应用Primer 5.0软件设计引物和探针(扩增的序列片段见图2)。将设计的引物、探针经美国国家生物技术信息中心(NCBI)网站上使用BLAST数据库比对确定引物和探针的理论特异性;鲑鱼内源基因采用于鱼类生长激素(扩增的序列片段见图1),用于鲑鱼来源样品DNA的检测及转基因成分的相对定量。具体引物探针信息见表1。|
|
注:阴影部分依次为上游引物GH-F,探针GH-P,下游引物GH-R 图1 GH部分扩增序列 Figure 1 Portion sequence for amply GH |
|
|
注:下划线部分为鲑鱼基因组序列;阴影部分依次为上游引物Aqu-F,探针Aqu-P,下游引物Aqu-R 图2 AAS的5’端部分边界序列 Figure 2 Portion 5’ flanking sequence of AAS |
|
|
表1 实时荧光PCR的引物、探针 Table 1 Sequence of primer pair/probe used in this study |

|
注:A为本试验引物探针设计的5’端边界序列区域 图3 AFP-GHc2结构图 Figure 3 Schematic representation of opAFP-GHc2 |
1.2.4 实时荧光PCR法特异性测试
采用大西洋鲑鱼、赤鮸鱼、带鱼、金线鱼、龙虾、鲈鱼、乌鲳鱼、鲳鱼、帝王蟹、青口贝和白虾的DNA为模板,阳性样品为转基因鲑鱼AFP-Aqu质粒,阴性对照为大豆DNA。对建立的实时荧光PCR检测方法进行特异性测试。
1.2.5 重复性测试及标准曲线建立
将分别将提取的AFP-Aqu质粒DNA溶液稀释至300 000、30 000、15 000、3 000、1 500、300、150、30、15拷贝/μl,加入2 μl作为模板,进行实时荧光PCR检测,每份样品3个平行,根据其Ct值的计算标准偏差(SD)和相对标准偏差(RSD),并选择线性范围建立标准曲线。
1.2.6 灵敏度测试
将转基因鲑鱼AFP-Aqu质粒DNA用ddH2O稀释至300、150和30拷贝/μl分别进行扩增,测定本方法的定量下限(limit of quantification,LOQ),每个浓度20个重复。统计Ct值分析得出LOQ。
2 结果与分析
2.1 实时荧光PCR检测方法的建立与优化
退火温度分别为60和58 ℃时,A、B、C组的引物和探针终浓度配比结果如图4、5所示,A、B、C组引物与探针均得到良好的扩增曲线,结合扩增曲线、Ct值及经济性,拟选择B组作为体系反应的浓度。B组引物探针在58和60 ℃检测的Ct值相差不明显,结合检测方法的通用性,选择退火温度为60 ℃。
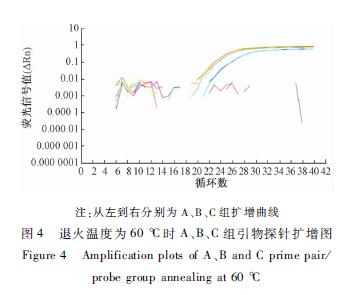
|
注:从左到右分别为A、B、C组扩增曲线 图4 退火温度为60 ℃时A、B、C组引物探针扩增图 Figure 4 Amplification plots of A、B and C prime pair/ probe group annealing at 60 ℃ |

|
注:从左到右分别为A组、B组和C组扩增曲线 图5 退火温度为58 ℃时A、B、C组引物探针扩增图 Figure 5 Amplification plots of A、B and C prime pair/ probe group annealing at 58 ℃ |
2.2 实时荧光PCR方法特异性测试
以大西洋鲑鱼等12种非转基因鲑鱼样品的DNA和转基因鲑鱼阳性质粒AFP-Aqu质粒的DNA为模板,采用AAS的品系特异引物和探针Aqu-F/R/P进行实时荧光PCR扩增,如图6所示,只有转基因鲑鱼AFP-Aqu质粒的DNA成功扩增,其他DNA样品均无典型的实时荧光扩增曲线。上述结果表明AAS的品系特异性引物和探针的特异性良好。
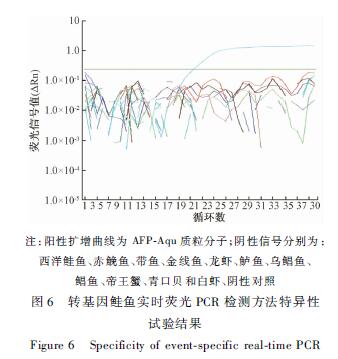
|
注:阳性扩增曲线为AFP-Aqu质粒分子;阴性信号分别为: 西洋鲑鱼、赤鮸鱼、带鱼、金线鱼、龙虾、鲈鱼、乌鲳鱼、 鲳鱼、帝王蟹、青口贝和白虾、阴性对照 图6 转基因鲑鱼实时荧光PCR检测方法特异性 试验结果 Figure 6 Specificity of event-specific real-time PCR |
2.3 重复性测试及标准曲线建立
将提取AFP-Aqu质粒DNA稀释至300 000、30 000、15 000、3 000、1 500、300、150、30、15 拷贝/μl,加入2 μl DNA作为模板,进行AAS实时荧光PCR检测,每份样品进行3次重复试验,水为空白对照,计算Ct值的SD和RSD,如表2所示,扩增曲线如图7所示。由表2可知,在模板量为600 000~60拷贝范围内所得的Ct值表明,其SD介于0.03~0.35,RSD介于0.12%~1.01%均在可接受范围内[11],即600 000~60拷贝范围内可重复性良好。采用600 000~60拷贝8个浓度梯度所得Ct值建立标准曲线,其线性回归方程为:y=-3.2194x+40.805,R2=0.997>0.98,扩增效率为104%(介于90%~110%),表明其线性相关性良好,扩增效率良好,均符合欧洲转基因实验室联盟(ENGL)相关要求[11]。
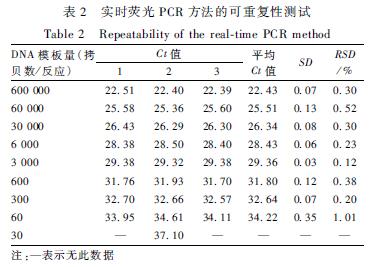
|
表2 实时荧光PCR方法的可重复性测试 Table 2 Repeatability of the real-time PCR method 注:—表示无此数据 |
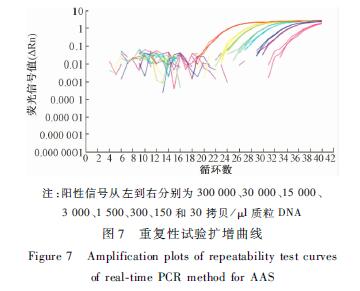
|
注:阳性信号从左到右分别为300 000、30 000、15 000、 3 000、1 500、300、150和30 拷贝/μl质粒DNA 图7 重复性试验扩增曲线 Figure 7 Amplification plots of repeatability test curves of real-time PCR method for AAS |
2.4 灵敏度测试
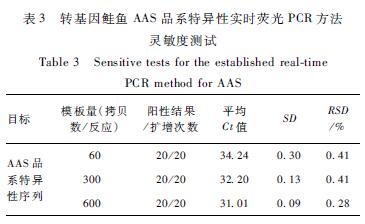
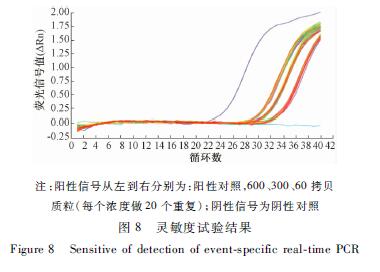
在2.3线性范围内采用转基因鲑鱼AFP-Aqu质粒DNA的30、150、300拷贝/μl三个梯度分别进行扩增,模板量2 μl,每个浓度20个重复,检测结果如表3和图8所示。以60拷贝扩增20次均出现阳性扩增,Ct值间的RSD<0.25%,随着DNA浓度降低,SD逐渐变大,为得到稳定的扩增和定量结果,因此确定本方法的LOQ为60拷贝质粒DNA。
|
表3 转基因鲑鱼AAS品系特异性实时荧光PCR方法 灵敏度测试 Table 3 Sensitive tests for the established real-time PCR method for AAS 注:阳性信号从左到右分别为:阳性对照,600、300、60拷贝 质粒(每个浓度做20个重复);阴性信号为阴性对照 |
|
图8 灵敏度试验结果 Figure 8 Sensitive of detection of event-specific real-time PCR |
3 小结
转基因三文鱼AAS是世界上第一个获批可直接食用的动物来源的转基因食品[12]。在水丰技术公司转基因鲑鱼AAS等待美国FDA审批的十几年中,已有20家30种转基因鱼和转基因动物正在研究开发之中,其中有几种已经向FDA申请商业化[1]。转基因鲑鱼AAS的上市,将为后面一大批送审的其他转基因食用动物提供了示范效应,对人们的生活将产生深远影响[13-15]。目前各国对于转基因植物产品认定的阈值各不相同[6,16],转基因动物产品的尚未制定相关阈值。为保障消费者的知情权和选择权并为检疫监管部门提供转基因鲑鱼AAS产品标识的技术支持,建立准确、高通量、快速的转基因鲑鱼AAS检测技术至关重要。本试验针对美洲绵鳚抗冻蛋白基因启动子区域与鲑鱼基因组5’端邻接区序列建立的转基因鲑鱼AAS品系特异性实时荧光PCR方法,可实现对AAS品系高度特异、灵敏的检测与鉴定,满足口岸检验检疫部门的实际需求。
参考文献
[1] 王大元. 美国转基因三文鱼商业化的启示[J]. 科学通报, 2016,61(3):289-295.
[2] 向治霖. 转基因三文鱼诞生记[J]. 方圆, 2015(36):62-65.
[3] 林雨晨. 动物转基因食品在美国首次上市[J]. 食品安全导刊, 2015(34):11.
[4] AquAdvantage salmon[EB/OL]. (2017-08-24)[2017-09-08].https://en.wikipedia.org/wiki/AquAdvantage_salmon.
[5] GROSSMAN M R. Genetically engineered animals in the United States: the AquAdvantage salmon[J]. European Food & Feed Law Review,2016,11(3):190.
[6] BEN H A, NABI N, ZELLAMA M S, et al. A new specific reference gene based on growth hormone gene (GH1) used for detection and relative quantification of Aquadvantage GM salmon (Salmo salar L.) in food products[J]. Food Chemistry, 2015, 190(6):1040-1045.
[7] 刘二龙, 卢丽, 吕英姿,等. 转基因苜蓿草J101品系特异性实时荧光PCR检测方法的建立[J]. 植物检疫, 2015, 29(3):77-82.
[8] 中华人民共和国农业部.农业转基因生物标识管理办法:农业部令第10号[A/OL].(2002-03-20)[2017-03-20]. http://www.moa.gov.cn/ztzl/zjyqwgz/zcfg/201007/t20100717_1601302.htm.
[9] HOLST-JENSEN A, RNNING S B, LVSETH A, et al. PCR technology for screening and quantification of genetically modified organisms (GMOs)[J]. Analytical and Bioanalytical Chemistry, 2003,375(8): 985-993.
[10] 中华人民共和国国家质量监督检验检疫总局. 食品中常见鱼类及其制品的鉴伪方法 第3部分:鲑鱼成分检测实时荧光PCR法:SN/T 3589.3—2013[S].北京:中国标准出版社,2013.
[11] European Network of GMO laboratories(ENGL).Definition of minimum performance requirements for analytical methods of GMO testing[EB/OL](2008-10-13)[2014-11-01].http://gmo-crl.jrc.ec.europa.eu/ doc/Min-Perf-requirements Analytical methods.pdf.
[12] FLETCHER G L, SHEARS M A, YASKOWIAK E S, et al. Gene transfer: potential to enhance the genome of Atlantic salmon for aquaculture[J]. Animal Production Science, 2004, 44(11):1095-1100.
[13] 马志英, 金月梅. 转基因三文鱼上市:转基因食品已从植物跨域到动物[J]. 生命与灾害, 2016(2):32-33.
[14] BUCHANAN J. The regulatory pathway for genetically engineered AquAdvantage salmon[J]. International Plant and Animal Genome Conference, 2014.
[15] CLIFFORD H. AquAdvantage salmon a pioneering application of biotechnology in aquaculture[J]. Bmc Proceedings, 2014, 8(Suppl 4):1-2.
[16] WU G, WU Y H, XIAO L, et al. Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J]. Food Chemistry, 2009, 112(1):232-238.
[2] 向治霖. 转基因三文鱼诞生记[J]. 方圆, 2015(36):62-65.
[3] 林雨晨. 动物转基因食品在美国首次上市[J]. 食品安全导刊, 2015(34):11.
[4] AquAdvantage salmon[EB/OL]. (2017-08-24)[2017-09-08].https://en.wikipedia.org/wiki/AquAdvantage_salmon.
[5] GROSSMAN M R. Genetically engineered animals in the United States: the AquAdvantage salmon[J]. European Food & Feed Law Review,2016,11(3):190.
[6] BEN H A, NABI N, ZELLAMA M S, et al. A new specific reference gene based on growth hormone gene (GH1) used for detection and relative quantification of Aquadvantage GM salmon (Salmo salar L.) in food products[J]. Food Chemistry, 2015, 190(6):1040-1045.
[7] 刘二龙, 卢丽, 吕英姿,等. 转基因苜蓿草J101品系特异性实时荧光PCR检测方法的建立[J]. 植物检疫, 2015, 29(3):77-82.
[8] 中华人民共和国农业部.农业转基因生物标识管理办法:农业部令第10号[A/OL].(2002-03-20)[2017-03-20]. http://www.moa.gov.cn/ztzl/zjyqwgz/zcfg/201007/t20100717_1601302.htm.
[9] HOLST-JENSEN A, RNNING S B, LVSETH A, et al. PCR technology for screening and quantification of genetically modified organisms (GMOs)[J]. Analytical and Bioanalytical Chemistry, 2003,375(8): 985-993.
[10] 中华人民共和国国家质量监督检验检疫总局. 食品中常见鱼类及其制品的鉴伪方法 第3部分:鲑鱼成分检测实时荧光PCR法:SN/T 3589.3—2013[S].北京:中国标准出版社,2013.
[11] European Network of GMO laboratories(ENGL).Definition of minimum performance requirements for analytical methods of GMO testing[EB/OL](2008-10-13)[2014-11-01].http://gmo-crl.jrc.ec.europa.eu/ doc/Min-Perf-requirements Analytical methods.pdf.
[12] FLETCHER G L, SHEARS M A, YASKOWIAK E S, et al. Gene transfer: potential to enhance the genome of Atlantic salmon for aquaculture[J]. Animal Production Science, 2004, 44(11):1095-1100.
[13] 马志英, 金月梅. 转基因三文鱼上市:转基因食品已从植物跨域到动物[J]. 生命与灾害, 2016(2):32-33.
[14] BUCHANAN J. The regulatory pathway for genetically engineered AquAdvantage salmon[J]. International Plant and Animal Genome Conference, 2014.
[15] CLIFFORD H. AquAdvantage salmon a pioneering application of biotechnology in aquaculture[J]. Bmc Proceedings, 2014, 8(Suppl 4):1-2.
[16] WU G, WU Y H, XIAO L, et al. Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J]. Food Chemistry, 2009, 112(1):232-238.
 刘二龙,卢丽,吕英姿,蒋湘,李立霞,李嘉琪,杜雅萍,郑高彬.转基因鲑鱼AquAdvantage品系特异性实时荧光聚合酶链式反应检测方法的建立[J].中国食品卫生杂志,2017,29(5):576-580.
刘二龙,卢丽,吕英姿,蒋湘,李立霞,李嘉琪,杜雅萍,郑高彬.转基因鲑鱼AquAdvantage品系特异性实时荧光聚合酶链式反应检测方法的建立[J].中国食品卫生杂志,2017,29(5):576-580.